
Redox balanceringsmetode trin, eksempler, øvelser
Det redox afbalanceringsmetode Det er den, der gør det muligt at afbalancere de kemiske ligninger af redoxreaktionerne, hvilket ellers ville være hovedpine. Her udveksler en eller flere arter elektroner; den der donerer eller mister dem kaldes den oxiderende art, mens den der accepterer eller vinder dem, den reducerende art.
I denne metode er det vigtigt at kende antallet af oxidationer af disse arter, da de afslører, hvor mange elektroner de har fået eller mistet pr. Mol. Takket være dette er det muligt at afbalancere de elektriske ladninger ved at skrive elektronerne i ligningerne som om de var reaktanter eller produkter..
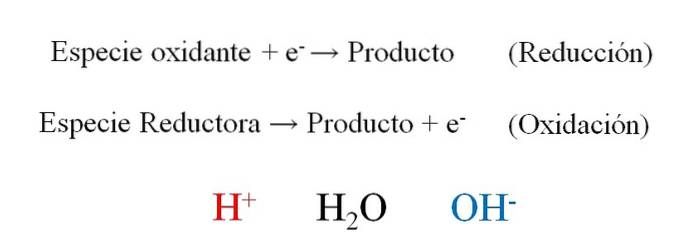
Billedet ovenfor viser, hvor effektivt elektroner, og- de placeres som reaktanter, når den oxiderende art vinder dem; og som produkter, når den reducerende art mister dem. Bemærk at for at afbalancere disse typer af ligninger er det nødvendigt at mestre begreberne oxidation og oxidationsreduktionstal..
Arten H+, HtoO og OH-, Afhængigt af reaktionsmediets pH tillader det redoxbalancering, hvorfor det er meget almindeligt at finde dem i øvelser. Hvis mediet er surt, vender vi os mod H+; men hvis mediet tværtimod er grundlæggende, så bruger vi OH- til rocking.
Selve reaktionens natur dikterer, hvad mediumets pH skal være. Derfor, selvom det kan være afbalanceret under antagelse af et surt eller basisk medium, vil den endelige afbalancerede ligning indikere, om H-ionerne virkelig kan dispenseres eller ej.+ og OH-.
Artikelindeks
- 1 trin
- 1.1 - Generelt
- 1.2 - Balancering i et surt medium
- 1.3 - Afbalancering i basismedium
- 2 Eksempler
- 3 Øvelser
- 3.1 Øvelse 1
- 3.2 Øvelse 2
- 4 Referencer
Trin
- Generel
Kontroller oxidationsnumrene på reaktanterne og produkterne
Antag følgende kemiske ligning:
Cu (s) + AgNO3(ac) → Cu (NO3)to + Ag (er)
Dette svarer til en redoxreaktion, hvor der sker en ændring i oxidationstallene for reaktanterne:
Cu0(s) + Ag+IKKE3(ac) → Cuto+(IKKE3)to + Ag (er)0
Identificer de oxiderende og reducerende arter
Den oxiderende art vinder elektroner ved at oxidere den reducerende art. Derfor falder dets oxidationsnummer: det bliver mindre positivt. I mellemtiden stiger oxidationsnummeret for de reducerende arter, da det mister elektroner: det bliver mere positivt..
I den foregående reaktion oxideres kobber således, da det passerer fra Cu0 til Cuto+; og sølv reduceres, når det passerer fra Ag+ til Ag0. Kobber er den reducerende art og sølv den oxiderende art.
Skriv halvreaktioner og balance atomer og ladninger
Ved at identificere, hvilke arter der vinder eller mister elektroner, er redox-halvreaktionerne skrevet til både reduktions- og oxidationsreaktioner:
Cu0 → Cuto+
Ag+ → Ag0
Kobber mister to elektroner, mens sølv får en. Vi placerer elektronerne i begge halvreaktioner:
Cu0 → Cuto+ + 2e-
Ag+ + og- → Ag0
Bemærk, at belastningerne forbliver afbalancerede i begge halvreaktioner; men hvis de blev føjet sammen, ville loven om bevarelse af materie blive overtrådt: antallet af elektroner skal være ens i de to halvreaktioner. Derfor ganges den anden ligning med 2, og de to ligninger tilføjes:
(Cu0 → Cuto+ + 2e-) x 1
(Ag+ + og- → Ag0) x 2
Cu0 + 2Ag+ + 2e- → Cuto+ + 2Ag0 + 2e-
Elektronerne annullerer, fordi de er på siderne af reaktanterne og produkterne:
Cu0 + 2Ag+ → Cuto+ + 2Ag0
Dette er den globale ionlige ligning.
Erstat koefficienter fra den ioniske ligning til den generelle ligning
Endelig overføres de støkiometriske koefficienter fra den foregående ligning til den første ligning:
Cu (s) + 2AgNO3(ac) → Cu (NO3)to + 2Ag (er)
Bemærk, at 2 var placeret med AgNO3 for i dette salt er sølvet som Ag+, og det samme sker med Cu (NO3)to. Hvis denne ligning ikke er afbalanceret i slutningen, fortsætter vi med at udføre retssagen.
Ligningen, der blev foreslået i de foregående trin, kunne have været afbalanceret direkte ved forsøg og fejl. Der er dog redoxreaktioner, der kræver et surt medium (H+) eller basisk (OH-) at finde sted. Når dette sker, kan det ikke balanceres, forudsat at mediet er neutralt; som netop vist (ingen H+ og heller ikke OH-).
På den anden side er det praktisk at vide, at de atomer, ioner eller forbindelser (for det meste oxider), hvori ændringerne i oxidationstal forekommer, er skrevet i halvreaktionerne. Dette vil blive fremhævet i øvelsesafsnittet.
- Balance i syremedium
Når mediet er surt, er det nødvendigt at stoppe ved de to halvreaktioner. Denne gang, når vi balancerer, ignorerer vi ilt- og brintatomerne og også elektronerne. Elektroner balancerer i sidste ende.
Derefter, på siden af reaktionen med færre iltatomer, tilføjer vi vandmolekyler for at kompensere for det. På den anden side afbalancerer vi hydrogenerne med H-ioner+. Og endelig tilføjer vi elektronerne og fortsætter med at følge de generelle trin, der allerede er beskrevet..
- Balance i grundlæggende medium
Når mediet er basisk, fortsætter man på samme måde som i det sure medium med en lille forskel: denne gang på den side, hvor der er mere ilt, vil et antal vandmolekyler lig med dette overskydende ilt blive placeret; og på den anden side OH-ioner- for at kompensere for hydrogener.
Endelig er elektronerne afbalanceret, de to halvreaktioner tilføjes, og koefficienterne for den globale ionlige ligning erstattes i den generelle ligning.
Eksempler
Følgende afbalancerede og ubalancerede redoxligninger fungerer som eksempler for at se, hvor meget de ændres efter anvendelse af denne afbalanceringsmetode:
P4 + ClO- → PO43- + Cl- (ubalanceret)
P4 + 10 ClO- + 6 timertoO → 4 PO43- + 10 Cl- + 12 timer+ (afbalanceret syremedium)
P4 + 10 ClO- + 12 OH- → 4 PO43- + 10 Cl- + 6 timertoO (afbalanceret medium grundlæggende)
jegto + KNO3 → Jeg- + KIO3 + IKKE3- (ubalanceret)
3Ito + KNO3 + 3HtoO → 5I- + KIO3 + IKKE3- + 6H+ (afbalanceret syremedium)
CrtoELLERto7- + HNOto → Cr3+ + IKKE3- (ubalanceret)
3HNOto + 5H+ + CrtoELLERto7- → 3NO3- +2Cr3+ + 4HtoO (afbalanceret syremedium)
Uddannelse
Øvelse 1
Balancér følgende ligning i basismediet:
jegto + KNO3 → Jeg- + KIO3 + IKKE3-
Generelle trin
Vi begynder med at skrive oxidationsnumrene for de arter, som vi har mistanke om er blevet oxideret eller reduceret; i dette tilfælde iodatomer:
jegto0 + KNO3 → Jeg- + KI5+ELLER3 + IKKE3-
Bemærk, at jod oxideres og samtidig reduceres, så vi fortsætter med at skrive deres to respektive halvreaktioner:
jegto → Jeg- (reduktion, for hvert jeg- 1 elektron forbruges)
jegto → IO3- (oxidation, for hver IO3- 5 elektroner frigives)
I oxidationshalvreaktionen placerer vi anionen IO3-, og ikke jodatomet som jeg5+. Vi afbalancerer jodatomer:
jegto → 2I-
jegto → 2IO3-
Balance i grundlæggende medium
Nu fokuserer vi på at afbalancere oxidationshalvreaktionen i et basisk medium, da det har en iltet art. Vi tilføjer på produktsiden det samme antal vandmolekyler, som der er iltatomer:
jegto → 2IO3- + 6HtoELLER
Og på venstre side afbalancerer vi hydrogenerne med OH-:
jegto + 12OH- → 2IO3- + 6HtoELLER
Vi skriver de to halvreaktioner og tilføjer de manglende elektroner for at afbalancere de negative ladninger:
jegto + 2e- → 2I-
jegto + 12OH- → 2IO3- + 6HtoO + 10e-
Vi udligner antallet af elektroner i begge halvreaktioner og tilføjer dem:
(JEGto + 2e- → 2I-) x 10
(JEGto + 12OH- → 2IO3- + 6HtoO + 10e-) x 2
12Ito + 24 OH- + 20e- → 20I- + 4IO3- + 12HtoO + 20e-
Elektronerne slettes, og vi deler alle koefficienter med fire for at forenkle den globale ionlige ligning:
(12Ito + 24 OH- → 20I- + 4IO3- + 12HtoO) x ¼
3Ito + 6OH- → 5I- + IO3- + 3HtoELLER
Og endelig erstatter vi koefficienterne for den ioniske ligning i den første ligning:
3Ito + 6OH- + KNO3 → 5I- + KIO3 + IKKE3- + 3HtoELLER
Ligningen er allerede afbalanceret. Sammenlign dette resultat med afbalanceringen i syremedium i eksempel 2.
Øvelse 2
Balancér følgende ligning i et surt medium:
TrotoELLER3 + CO → Fe + COto
Generelle trin
Vi ser på oxidationstallene for jern og kulstof for at finde ud af, hvilken af de to der er blevet oxideret eller reduceret:
Troto3+ELLER3 + Cto+O → Tro0 + C4+ELLERto
Jern er blevet reduceret, hvilket gør det til den oxiderende art. I mellemtiden er kulstoffet oxideret og opfører sig som den reducerende art. De berørte halvreaktioner til oxidation og reduktion er:
Troto3+ELLER3 → Tro0 (reduktion, for hver Fe forbruges 3 elektroner)
CO → COto (oxidation, for hver COto 2 elektroner frigives)
Bemærk, at vi skriver oxid, FetoELLER3, fordi det indeholder tro3+, i stedet for bare at placere Fe3+. Vi afbalancerer de nødvendige atomer undtagen ilt:
TrotoELLER3 → 2Fe
CO → COto
Og vi fortsætter med at udføre balanceringen i et surt medium i begge halvreaktioner, da der er iltede arter imellem..
Balance i syremedium
Vi tilføjer vand for at afbalancere oxygener og derefter H+ at balancere hydrogener:
TrotoELLER3 → 2Fe + 3HtoELLER
6H+ + TrotoELLER3 → 2Fe + 3HtoELLER
CO + HtoO → COto
CO + HtoO → COto + 2H+
Nu afbalancerer vi ladningerne ved at placere de elektroner, der er involveret i halvreaktionerne:
6H+ + 6e- + TrotoELLER3 → 2Fe + 3HtoELLER
CO + HtoO → COto + 2H+ + 2e-
Vi udligner antallet af elektroner i begge halvreaktioner og tilføjer dem:
(6H+ + 6e- + TrotoELLER3 → 2Fe + 3HtoO) x 2
(CO + HtoO → COto + 2H+ + 2e-) x 6
12 timer+ + 12e- + 2FetoELLER3 + 6CO + 6HtoO → 4Fe + 6HtoO + 6COto + 12H+ + 12e-
Vi annullerer elektronerne, H-ionerne+ og vandmolekylerne:
2FetoELLER3 + 6CO → 4Fe + 6COto
Men disse koefficienter kan divideres med to for at forenkle ligningen endnu mere ved at have:
TrotoELLER3 + 3CO → 2Fe + 3COto
Dette spørgsmål opstår: var redoxbalancering nødvendig for denne ligning? Ved forsøg og fejl ville det have været meget hurtigere. Dette viser, at denne reaktion fortsætter uanset mediumets pH..
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Helmenstine, Anne Marie, Ph.D. (22. september 2019). Sådan afbalanceres Redox-reaktioner. Gendannet fra: thoughtco.com
- Ann Nguyen & Luvleen Brar. (5. juni 2019). Afbalancering af redoxreaktioner. Kemi LibreTexts. Gendannet fra: chem.libretexts.org
- Quimitube. (2012). Øvelse 19: Justering af en redoxreaktion i basisk medium med to oxidationshalvreaktioner. Gendannet fra: quimitube.com
- Washington University i St. Louis. (s.f.). Øvelsesproblemer: Redox-reaktioner. Gendannet fra: chemistry.wustl.edu
- John Wiley & Sons. (2020). Sådan afbalanceres redoxligninger. Gendannet fra: dummies.com
- Rubén Darío O. G. (2015). Balancering af kemiske ligninger. Gendannet fra: aprendeenlinea.udea.edu.co


Endnu ingen kommentarer