
Kaliumnitrit (KNO2) struktur, egenskaber og anvendelser

Det kaliumnitrit er et uorganisk salt, hvis kemiske formel er KNOto, som er kemisk og farmakologisk relateret til kaliumnitrat, KNO3. Dens fysiske udseende består af gulhvide krystaller, meget hygroskopiske og derfor delikat; de opløses hurtigt i fugtige omgivelser.
Dens formel indikerer, at andelen af K-ioner+ og nejto- er 1: 1, og de holdes sammen af elektrostatiske kræfter eller ionbindinger. Ingen rene naturlige kilder ser ud til at være fundet for dets krystaller, selvom nitritanioner kan findes i jord, gødning, planter og dyr..

Billedet ovenfor viser, hvordan KNO-krystallerne ser udto, med markante gule toner. Hvis disse krystaller efterlades i kontakt med luften, absorberer de fugt, indtil de bliver en vandig opløsning; løsning, der har skabt kontroverser med hensyn til, om brugen til medicinske formål er gavnlig eller ej.
På den anden side bruges dets krystaller i meget små mængder (200 ppm) til at saltopløse kød og garantere deres konservering mod bakteriel virkning. Ligeledes KNOto forbedrer farven på kød, hvilket gør dem mere rødlige; det er dog underlagt flere begrænsninger for at undgå de toksiske virkninger af dette salt i kroppen.
Artikelindeks
- 1 Struktur af kaliumnitrit
- 2 egenskaber
- 2.1 Molekylær masse
- 2.2 Densitet
- 2.3 Smeltepunkt
- 2.4 Kogepunkt
- 2.5 Opløselighed i vand
- 2.6 Deliquescence
- 2.7 Opløselighed i andre opløsningsmidler
- 2,8 pH
- 3 Nomenklatur
- 4 Opnåelse
- 5 anvendelser
- 5.1 Tilsætningsstof og reagens
- 5.2 Modgift
- 5.3 Læger
- 6 Referencer
Struktur af kaliumnitrit
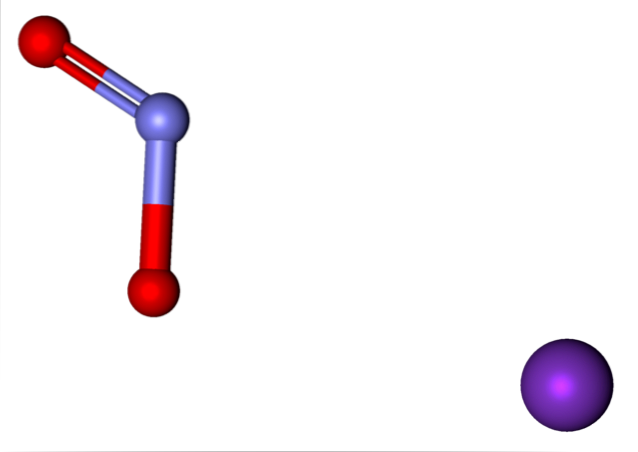
Ionerne til stede i kaliumnitrit er vist ovenfor. K-kationen+ svarer til den lilla kugle, mens NO-anionento- er repræsenteret af de blålige og røde kugler.
Anion NEJto- vist med en dobbelt og en enkelt binding [O = N-O]-; men i virkeligheden er begge obligationer lige produkt af resonansen af den negative ladning imellem dem.
K-ioner+ og nejto- de tiltrækker hinanden i rummet, indtil de organiserer et strukturelt mønster med mindst mulig energi; dette er, hvor frastødningen mellem lige ladninger er minimal. Og så skaber de KNO-krystallerto, hvis enhedscelle er modtagelig for temperaturændringer, hvilken fase overgår.
F.eks. Ved lave temperaturer (mindre end 25 ° C) KNO-krystallerto vedtage et monoklinisk system (fase I). Når temperaturen overstiger 25 ° C, sker der en faseovergang fra monoklin til rhombohedral (fase II). Endelig over 40 ° C KNO krystallerto skift til kubisk (fase III).
Ligeledes KNOto det kan udvise andre krystallinske faser (faser IV, V og VI) under høje tryk. Med dette K-ionerne+ og nejto- de ender med at bevæge sig og bestille på forskellige måder i deres rene krystaller.
Ejendomme
Molekylær masse
85,1038 g / mol.
Massefylde
1,9150 g / ml.
Smeltepunkt
440,02 ° C (men begynder at nedbrydes fra 350 ° C og udsender giftige dampe).
Kogepunkt
537 ° C (eksploderer).
Vandopløselighed
312 g / 100 g vand ved 25 ° C.
Deliquescence
Dens opløselighed i vand er sådan, at den er hygroskopisk; så meget, at det udviser delikatens og absorberer nok fugt til at opløse sig. Denne affinitet for vand kan skyldes den energiske stabilitet, som K-ioner får+ når det er hydreret, samt en lav gitterenthalpi til KNO-krystallerto.
Krystaller kan absorbere vand uden at opløses for at blive et hydrat, KNOtoHtoO. I hydratet findes vandmolekylet, der ledsager ionerne, hvilket modificerer den krystallinske struktur.
Dette hydrat (eller flere af dem) kan dannes under -9 ° C; ved højere temperaturer opløses og hydrerer vandet ionerne og deformerer krystallen.
Opløselighed i andre opløsningsmidler
Let opløselig i varme alkoholer og meget opløselig i ammoniak.
pH
6-9. Dens vandige opløsninger er derfor basiske, da anionen NOto- kan hydrolyseres.
Nomenklatur
Til KNOto det kan også navngives på andre måder. 'Kaliumnitrit' svarer til navnet på dette salt i henhold til stamnomenklaturen 'kaliumnitrit' i henhold til den systematiske nomenklatur, hvor den eneste valens af kalium, +1, er fremhævet og kaliumdioxonitrat (III) i henhold til den systematiske nomenklatur.
Navnet 'kaliumdioxonitrat (III)' fremhæver nitrogenatomets +3-valens. Selvom det er det mest anbefalede navn fra IUPAC til KNOto, 'kaliumnitrit' er fortsat det mest bekvemme og letteste at huske.
Opnåelse
Den mest direkte måde at syntetisere det på, men med et lavere udbytte, er gennem termisk nedbrydning af kaliumnitrat eller saltpeter ved 400 ° C eller mere:
2KNO3 => KNOto + ELLERto
Imidlertid en del af KNOto Det ender med at nedbrydes af varmen, ud over at andre produkter dannes.
En anden metode til at forberede eller syntetisere det med et højere udbytte er ved at reducere KNO3 i nærværelse af bly, kobber eller zink. Ligningen for denne reaktion er som følger:
KNO3 + Pb => KNOto + PbO
Kaliumnitrat og bly blandes støkiometrisk i en jernpande, hvor de smelter under konstant omrøring og opvarmning i en halv time. Bly (II) oxid er gul i farven, og den resulterende masse pulveriseres varm og behandles med kogende vand. Derefter filtreres den varme blanding.
Det varme filtrat bobles med kuldioxid i fem minutter, hvilket vil udfælde blycarbonat, PbCO3, uopløselig. På denne måde adskilles blyet fra filtratet. Fortyndet salpetersyre tilsættes til filtratet, indtil pH-værdien er neutral, den får lov til at afkøle, og til sidst fordampes vandet, så KNO-krystallerne dannes.to.
Ansøgninger
Additiv og reagens
Kaliumnitrit bruges som tilsætningsstof til at kurere rødt kød og opretholder dets smag og farve i længere tid under opbevaring, samtidig med at bakterienes og visse toksiners virkning forsinkes, såsom botulinum. Derfor udviser den antibakteriel virkning.
KNOto det oxideres til NO, som reagerer med myoglobin i kød og ender derfor med at ændre sin naturlige røde farve. Senere, når kødet er kogt, får det sin karakteristiske stærke lyserøde farve.
Dog under betingelser uden at specificere KNOto reagerer med kødproteiner for at give anledning til nitrosaminer, som kan blive kræftfremkaldende.
På den anden side KNOto (skønt fortrinsvis NaNOto) er et analytisk reagens, der kan bruges til syntese af azofarvestoffer (reaktionen af salpetersyre med aromatiske aminer) og til analyse af aminosyrer.
Modgift
Mens det har sine negative virkninger, KNOto fungerer som modgift hos patienter forgiftet med cyanider og hydrogensulfid. Dens mekanisme består i at oxidere Fe-centreneto+ til tro3+ af de grupper, vi har hæmoglobiner, der producerer methemoglobin, som derefter reagerer med CN-anionerne- og HS-.
Læger
I mavesaften i maven anionen NOto- det er reduceret til NO, hvilket vides at have en vasodilaterende virkning, hvilket øger blodgennemstrømningen. I andre områder af kroppen, hvor pH ikke er sur nok, er nogle enzymer, såsom xanthinoxidoreduktase, ansvarlige for at reducere NOto-.
KNO er blevet brugtto til behandling af lidelser og sygdomme som angina pectoris og epilepsi (med meget negative bivirkninger).
Referencer
- Wikipedia. (2019). Kaliumnitrit. Gendannet fra: en.wikipedia.org
- PrebChem. (2016). Fremstilling af kaliumnitrit. Gendannet fra: prepchem.com
- Mark Gilchrist, Angela C. Shore, Nigel Benjamin. (2011). Uorganisk nitrat og nitrit og kontrol af blodtryk, Kardiovaskulær forskning, bind 89, udgave 3, 15. februar 2011, sider 492-498, doi.org/10.1093/cvr/cvq309
- PubChem. (2019). Kaliumnitrit. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Kemisk formulering. (2018). Kaliumnitrit. Gendannet fra: formulacionquimica.com
- National Center for Advancing Translational Sciences. (2011). Kaliumnitrit. Gendannet fra: drugss.ncats.io
- Richard J. Epley, Paul B. Addis og Joseph J. Warthesen. (1992). Nitrit i kød. University of Minnesota.
- N. R. Rao, B. Prakash og M. Natarajan. (1975). Transformationer af krystalstruktur i uorganiske nitritter, nitrater og carbonater. Institut for Kemi, Indian Institute of Technology, Kanpur, Indien.



Endnu ingen kommentarer