
Ángström historie, anvendelser og ækvivalenser

Det angstrøm er en længdeenhed, der bruges til at udtrykke den lineære afstand mellem to punkter; især mellem to atomkerner. Lig med 10-8 cm eller 10-10 m, mindre end en milliarddel meter. Derfor er det en enhed, der bruges til meget små dimensioner. Det er repræsenteret med bogstavet i det svenske alfabet Å, til ære for fysikeren Ander Jonas Ångström (nederste billede), der introducerede denne enhed i løbet af sin forskning.
Angstrømmen finder anvendelse inden for forskellige områder inden for fysik og kemi. At være sådan en lille længdemåling er det uvurderlig i nøjagtighed og bekvemmelighed i atomforholdsmålinger såsom atomradius, bindingslængder og bølgelængder af det elektromagnetiske spektrum.
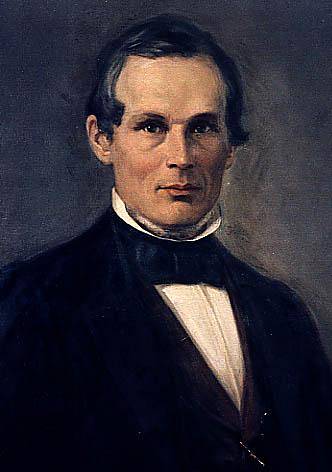
Selvom det i mange af dets anvendelser er henvist til SI-enheder, såsom nanometer og picometer, er det stadig gyldigt i områder som krystallografi og i studier af molekylære strukturer..
Artikelindeks
- 1 Historie
- 1.1 Fremkomst af enhed
- 1.2 Synligt spektrum
- 1.3 Å og SI
- 2 anvendelser
- 2.1 Atomeradier
- 2.2 Kemi og fysik i fast tilstand
- 2.3 Krystallografi
- 2.4 Bølgelængder
- 3 ækvivalenser
- 4 Referencer
Historie
Enhedens fremkomst
Anders Jonas Ångström blev født i Lödgo, en svensk by, den 13. august 1814 og døde i Uppsala (Sverige) den 21. juni 1874. Han udviklede sin videnskabelige forskning inden for fysik og astronomi. Han betragtes som en af pionererne i studiet af spektroskopi.
Ångström undersøgte varmeledning og forholdet mellem elektrisk ledningsevne og varmeledningsevne.
Ved hjælp af spektroskopi var han i stand til at studere den elektromagnetiske stråling fra forskellige himmellegemer og opdagede, at solen var lavet af brint (og andre grundstoffer, der gennemgår atomreaktioner).
Ångström skylder et kort over solspektret. Dette kort blev uddybet så detaljeret, at det omfatter tusind spektrallinjer, hvor han brugte en ny enhed: Å. Derefter blev brugen af denne enhed udbredt, opkaldt til ære for den person, der introducerede den.
I 1867 undersøgte Ångström spektret af elektromagnetisk stråling fra nordlyset og opdagede tilstedeværelsen af en lys linje i det grøn-gule område med synligt lys..
I 1907 blev Å brugt til at definere bølgelængden af en rød linje, der udsender cadmium, hvis værdi er 6.438,47 Å.
Synligt spektrum
Ångström anså det for praktisk at introducere enheden til at udtrykke de forskellige bølgelængder, der udgør spektret af sollys; især i området med synligt lys.
Når en solstråle falder på et prisme, opdeles det nye lys i et kontinuerligt spektrum af farver, der spænder fra violet til rødt; gennem indigo, grøn, gul og orange.
Farver er et udtryk for de forskellige længder, der findes i synligt lys, mellem ca. 4.000 Å og 7.000 Å.
Når en regnbue observeres, kan det specificeres, at den består af forskellige farver. Disse repræsenterer de forskellige bølgelængder, der udgør synligt lys, som nedbrydes af vanddråberne, der passerer gennem det synlige lys..
Selvom de forskellige bølgelængder (λ), der udgør spektret af sollys, udtrykkes i Å, er det også ret almindeligt at udtrykke dem i nanometer (nm) eller millimikraer, der svarer til 10-9 m.
Å og SI
Selvom enheden Å er blevet brugt i adskillige undersøgelser og publikationer i videnskabelige tidsskrifter og i lærebøger, er den ikke registreret i det internationale system for enheder (SI).
Sammen med Å er der andre enheder, som ikke er registreret i SI; De bruges dog fortsat i publikationer af anden art, videnskabelig og kommerciel..
Ansøgninger
Atomiske radier
Enheden Å bruges til at udtrykke dimensionen af atomernes radius. Radien af et atom opnås ved at måle afstanden mellem kernerne i to kontinuerlige og identiske atomer. Denne afstand er lig med 2 r, så atomradius (r) er halvdelen af den.
Atomernes radius svinger omkring 1 Å, så det er praktisk at bruge enheden. Dette minimerer de fejl, der kan foretages ved brug af andre enheder, da det ikke er nødvendigt at bruge kræfter på 10 med negative eksponenter eller tal med et stort antal decimaler.
For eksempel har vi følgende atomradier udtrykt i angstrøm:
-Klor (Cl) har en atomradius på 1 Å
-Lithium (Li), 1,52 Å
-Bor (B), 0,85 Å
-Carbon (C), 0,77 Å
-Oxygen (O), 0,73 Å
-Fosfor (P), 1,10 Å
-Svovl (S), 1,03 Å
-Kvælstof (N), 0,75 Å;
-Fluor (F), 0,72 Å
-Brom (Br), 1,14 Å
-Jod (I), 1,33 Å.
Selvom der er kemiske grundstoffer med en atomeradius større end 2 Å, blandt dem:
-Rubidium (Rb) 2,48 Å
-Strontium (Sr) 2,15 Å
-Cæsium (Cs) 2,65 Å.
Picometer vs Angstrom
Det er almindeligt i kemitekster at finde atomradier udtrykt i picometre (ppm), som er hundrede gange mindre end en angstrøm. Forskellen multiplicerer simpelthen ovenstående atomradier med 100; for eksempel er den atomare radius af kulstof 0,77 Å eller 770 ppm.
Solid state kemi og fysik
Å bruges også til at udtrykke størrelsen på et molekyle og rummet mellem et atoms planer i krystalstrukturer. På grund af dette anvendes Å i fast tilstandsfysik, kemi og krystallografi..
Derudover bruges det i elektronmikroskopi til at indikere størrelsen på mikroskopiske strukturer..
Krystallografi
Enheden Å bruges i krystallografistudier, der bruger røntgenstråler som basis, da disse har en bølgelængde mellem 1 og 10 Å.
Å bruges i positronkrystallografistudier i analytisk kemi, da alle kemiske bindinger er i området fra 1 til 6 Å.
Bølgelængder
Å bruges til at udtrykke bølgelængderne (λ) af elektromagnetisk stråling, især i området med synligt lys. For eksempel svarer farven grøn til en bølgelængde på 4.770 Å, og farven rød en bølgelængde på 6.231 Å.
I mellemtiden svarer ultraviolet stråling tæt på synligt lys til en bølgelængde på 3.543 Å.
Elektromagnetisk stråling har flere komponenter, herunder: energi (E), frekvens (f) og bølgelængde (λ). Bølgelængden er omvendt proportional med energien og frekvensen af elektromagnetisk stråling.
Derfor er jo større bølgelængde af elektromagnetisk stråling, jo lavere er dens frekvens og energi..
Ækvivalenser
Endelig er der nogle ækvivalenser af Å med forskellige enheder, som kan bruges som konverteringsfaktorer:
-10-10 meter / Å
-10-8 centimeter / Å
-10-7 mm / Å
-10-4 mikrometer (mikron) / Å.
-0,10 millimikron (nanometer) / Å.
-100 picometer / Å.
Referencer
- Helmenstine, Anne Marie, Ph.D. (5. december 2018). Angstrom Definition (Fysik og kemi). Gendannet fra: thoughtco.com
- Wikipedia. (2019). Angstrøm. Gendannet fra: es.wikipedia.org
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Regents ved University of California. (nitten seksoghalvfems). Elektromagnetiske spektrum. Gendannet fra: cse.ssl.berkeley.edu
- AVCalc LLC. (2019). Hvad er angstrøm (enhed). Gendannet fra: aqua-calc.com
- Angstrom - Manden og enheden. [PDF]. Gendannet fra: phycomp.technion.ac.il


Endnu ingen kommentarer