
Aluminiumnitratformler, egenskaber, anvendelser og risici
Det aluminiumnitrat Det er aluminiumsaltet af salpetersyre. Aluminiumnitrat nonahydrat ved stuetemperatur fremstår som et farveløst fast stof med duften af salpetersyre..
De er ikke brændbare, men de kan fremskynde forbrændingen af brændbare materialer. Hvis der er involveret store mængder aluminiumnitrat, eller hvis brændbart materiale er findelt, kan der opstå en eksplosion..

Langvarig eksponering for ild eller varme kan føre til en eksplosion. Når de kommer i kontakt med ild, producerer de nitrogenoxider. Dens anvendelser omfatter raffinering af olie og farvning og garvning af læder..
Det er et hvidt, vandopløseligt salt, der oftest forekommer i sin krystallinske nonahydratform (aluminiumnitrat nonahydrat)..
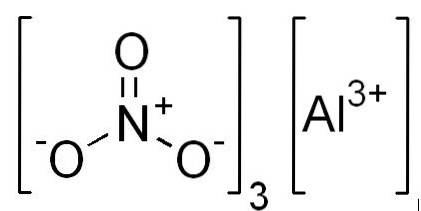
Artikelindeks
- 1 Formler
- 2 Struktur
- 2.1 I 2D
- 2.2 I 3D
- 3 Fysiske og kemiske egenskaber
- 3.1 Reaktivitetsalarmer
- 3.2 Reaktioner med luft og vand
- 3.3 Antændelighed
- 3.4 Reaktivitet
- 3.5 Toksicitet
- 4 anvendelser
- 5 Kliniske effekter
- 6 Sikkerhed og risici
- 6.1 GHS-fareklasser
- 6.2 Sikkerhedssætkoder
- 7 Referencer
Formler
- Aluminiumnitrat: Al (NO3)3
- Aluminiumnitrat nonahydrat: Al (NO3)3 9HtoELLER
- CAS: 13473-90-0 Aluminiumnitrat (vandfri)
- CAS: 14797-65-0 Aluminiumnitrat (nonahydrat)
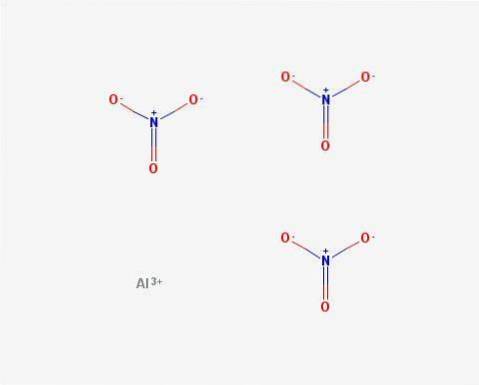
Struktur
I 2D
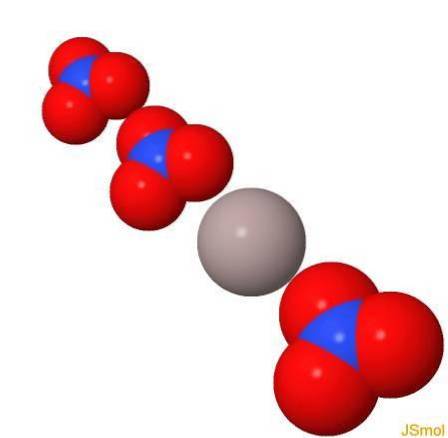
I 3d
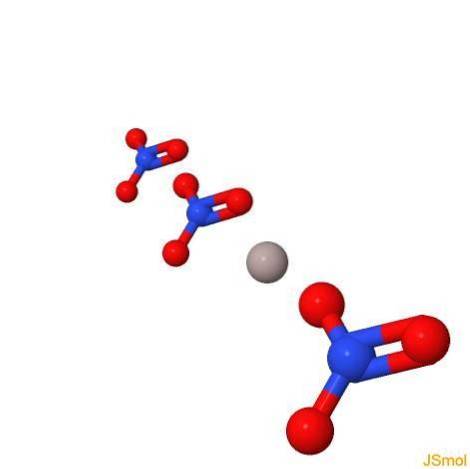
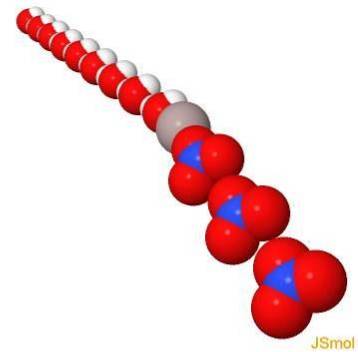
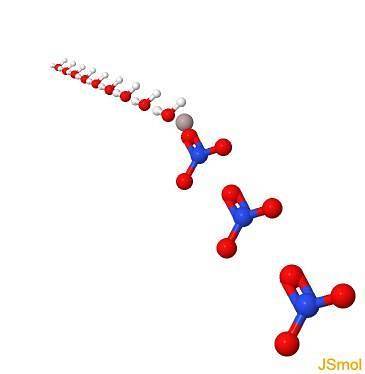
Fysiske og kemiske egenskaber
- Aluminiumnitrat tilhører den reaktive gruppe af uorganiske nitrat- og nitritforbindelser.
- Nitrationen er en polyatomisk ion med molekylformlen NO3 - og er den konjugerede base af salpetersyre.
- Næsten alle uorganiske nitratsalte er opløselige i vand ved standard temperatur og tryk..
- Nitratforbindelser har en lang række anvendelser baseret på deres aktivitet som oxidationsmidler, tilstedeværelsen af frit tilgængeligt nitrogen eller deres høje opløselighed..
Reaktivitetsadvarsler
Aluminiumnitrat er et stærkt oxidationsmiddel.
Reaktioner med luft og vand
Aluminiumnitrat er deliquescent (det har egenskaben at absorbere fugt fra luften for at danne en vandig opløsning). Det er opløseligt i vand. Dens vandige opløsninger er sure.
Brændbarhed
Nitrater og nitrit er eksplosive forbindelser. Nogle af disse stoffer kan nedbrydes eksplosivt, når de opvarmes eller er involveret i en brand. De kan eksplodere fra varme eller forurening. Beholdere kan eksplodere, når de opvarmes.
Særlige farer ved forbrændingsprodukter: giftige nitrogenoxider kan dannes i en brand, der involverer aluminiumnitrat.
Reaktivitet
Nitrater og nitrit kan virke som ekstremt kraftige oxidationsmidler og blandinger med reduktionsmidler eller reducerede materialer såsom organiske stoffer kan være eksplosive. Reager med syrer for at danne giftig nitrogendioxid.
Generelt er nitrat- og nitritsalte med redoxaktive kationer (overgangsmetaller og metaller fra gruppe 3a, 4a og 5a i det periodiske system såvel som ammoniumkationen [NH4] +) mere reaktive med organiske materialer og midler. under omgivende forhold.
Aluminiumnitrat er et oxidationsmiddel. Blandinger med alkylestere kan eksplodere. Blandinger med fosfor, tin (II) chlorid eller andre reduktionsmidler kan reagere eksplosivt.
Toksicitet
Mennesker er udsat for nitrat- og nitritstoksicitet, hvor børn er særligt sårbare over for methemoglobinæmi.
Indtagelse af store doser aluminiumnitrat forårsager gastrisk irritation, kvalme, opkastning og diarré. Kontakt med støv irriterer øjne og hud.
Ansøgninger
Nitrater og nitrit anvendes i vid udstrækning (og i meget store mængder) som gødning i landbruget på grund af deres vilje til at nedbryde og frigive kvælstof til plantevækst og på grund af deres opløselighed, hvilket gør det muligt at absorbere nitrationer af plantens rødder.
Nitratforbindelser anvendes også i vid udstrækning som et industrielt råmateriale, når der kræves et oxidationsmiddel eller en nitrationkilde..
Aluminiumnitrat anvendes til fremstilling af laboratorie-, kosmetiske og personlige hygiejnekemikalier. I industrien bruges det som mellemprodukt til fremstilling af andre stoffer.
Det bruges i lædergarvning, i antiperspiranter, korrosionshæmmere, i uranekstraktion, råolieraffinering og som et nitreringsmiddel..
Aluminiumnitrat nonahydrat og andre hydratiserede aluminiumnitrater har mange anvendelser. Disse salte bruges til at fremstille aluminiumoxid til fremstilling af isoleringspapir, i varmeelementer i katodestrålerør og i kernelaminaterne i transformere. Hydrerede salte anvendes også til ekstraktion af actinide grundstoffer.
Kliniske effekter
Aluminium er allestedsnærværende, det er det mest rigelige metal i jordskorpen. Mest menneskelig eksponering kommer fra mad. Det findes i nogle farmaceutiske produkter. I industrien er det meget brugt.
Aluminium hæmmer knoglemodellering og forårsager osteomalaki. Det menes at hæmme erythropoiesis, der forårsager anæmi.
Akut forgiftning er sjælden. Opløselige former af aluminium har større potentiale for toksicitet end uopløselige former på grund af deres større absorption..
Patienter med nyresvigt er tilbøjelige til aluminiumstoksicitet, enten fra aluminium i dialysatet eller andre eksogene kilder, især fosfatbindere og aluminiumholdige antacida..
Kronisk eksponering for aluminiumsstøv kan forårsage dyspnø, hoste, lungefibrose, pneumothorax, pneumokoniose, encefalopati, svaghed, inkoordination og epileptiforme anfald..
Aluminiumsalte kan forårsage irritation af øjne og slimhinder, konjunktivitis, dermatose og eksem..
Selvom aluminium og dets forbindelser har vist lidt tegn på kræftfremkaldende virkning hos mennesker, har eksponering for andre stoffer, der er involveret i aluminiumproduktion, været forbundet med kræftfremkaldende egenskaber..
Sikkerhed og risici
Faresætninger fra det globalt harmoniserede system for klassificering og mærkning af kemikalier (GHS).
Det globalt harmoniserede system til klassificering og mærkning af kemikalier (GHS) er et internationalt aftalt system, der er oprettet af FN og designet til at erstatte de forskellige klassificerings- og mærkningsstandarder, der anvendes i forskellige lande ved hjælp af ensartede kriterier globalt..
Risikoklasserne (og deres tilsvarende kapitel i GHS), klassificerings- og mærkningsstandarderne og anbefalingerne for aluminiumnitrat og aluminiumnitrat-nonahydrat er som følger (Det Europæiske Kemikalieagentur, 2017; De Forenede Nationer, 2015; PubChem, 2017):
GHS-fareklasser
H272: Kan forstærke ilden; Oxidizer [Advarsel Oxiderende væsker; Oxiderende faste stoffer - Kategori 3] (PubChem, 2017).
H301: Giftig ved indtagelse [Akut toksicitetsfare, oral - kategori 3] (PubChem, 2017).
H315: Forårsager hudirritation [Advarsel Hudætsning / -irritation - Kategori 2] (PubChem, 2017).
H318: Forårsager alvorlig øjenskade [Fare Alvorlig øjenskade / øjenirritation - Kategori 1] (PubChem, 2017).
H319: Forårsager alvorlig øjenirritation [Advarsel Alvorlig øjenskade / øjenirritation - Kategori 2A] (PubChem, 2017).
Sikkerhedssætnings koder
P210, P220, P221, P264, P270, P280, P301 + P310, P302 + P352, P305 + P351 + P338, P310, P321, P330, P332 + P313, P337 + P313, P362, P370 + P378, P405 og (PubChem, 2017).





Referencer
- ChemIDplus (2017) 3D-struktur af 13473-90-0 - Aluminiumnitrat [billede] Gendannet fra: chem.nlm.nih.gov.
- ChemIDplus (2017) 3D-struktur af 7784-27-2 - Aluminiumnitrat-nonahydrat [billede] Gendannet fra: chem.nlm.nih.gov.
- Daisa, J. (2017) Shell Oil Refinery at Dusk [image] Gendannet fra: flickr.com.
- Edgar181 (2008) Aluminiumnitrat [billede]. Gendannet fra: wikipedia.org.
- Det Europæiske Kemikalieagentur (ECHA). (2016). Aluminiumnitrat. Kort profil. Hentet den 8. februar 2017 fra echa.europa.eu.
- Databank over farlige stoffer (HSDB). TOXNET. (2017). Aluminiumnitrat. Bethesda, MD, EU: National Library of Medicine. Gendannet fra: chem.nlm.nih.gov.
- JSmol (2017) Nitrat [billede] Gendannet fra: chemapps.stolaf.edu.
- Wikipedia. (2017). Aluminiumnitrat. Hentet 8. februar 2017 fra: wikipedia.org.
- Wikipedia. (2017). Aluminiumnitrat nonahydrat. Hentet 8. februar 2017 fra: wikipedia.org.


Endnu ingen kommentarer