
Oxyhemoglobin egenskaber, struktur og bindingskurve
ELLERxihemoglobin Det er det navn, som hæmoglobin modtager, når det binder til ilt. Hæmoglobin er et protein, der findes i røde blodlegemer, hvis hovedfunktion er at transportere ilt fra lungerne til vævene..
De første levende væsener var encellede og levede i et flydende miljø, hvorfra de blev fodret, og hvorfra de fjernede deres affald, som nogle af de organismer, der findes i dag. Under disse betingelser opnås disse processer ved enkle diffusionsmekanismer, da cellevæggen er i intim kontakt med mediet, der forsyner det..
Udviklingen af stadig mere komplekse flercellede organismer antydede, at de indre celler bevægede sig betydeligt væk fra miljøet, så diffusionsmekanismerne som den eneste forsyningskilde blev utilstrækkelige..
Således blev der udviklet specialiserede systemer til at opnå næringsstoffer og gasser såsom fordøjelsessystemet og åndedrætssystemet samt transportmekanismer for at bringe disse næringsstoffer og gasser tættere på cellen: det kardiovaskulære system.
For at producere energi i form af ATP-molekyler har celler brug for ilt. Da ATP ikke kan lagres, skal det konstant syntetiseres, hvilket betyder en permanent efterspørgsel efter ilt fra cellerne..
Hæmoglobin opstod evolutionsmæssigt som en gastransportør, der "løste" problemet med ilttransport fra miljøet til cellen..
Artikelindeks
- 1 Egenskaber og struktur
- 1.1 Hvad er hæmoglobin til??
- 1.2 Hvordan ligner et hæmoglobinmolekyle?
- 1.3 Hvordan er hæm-gruppen?
- 1.4 Hvordan dannes oxyhemoglobin?
- 1.5 Hvad er den maksimale mængde ilt, som hæmoglobin kan bære?
- 2 Oxyhemoglobin-bindingskurve
- 3 Referencer
Karakteristika og struktur
For at tale om egenskaberne og strukturen ved oxyhemoglobin er det nødvendigt at henvise til hæmoglobin, da oxyhemoglobin ikke er andet end hæmoglobin bundet til ilt. Derfor, fra nu af, vil fælleskarakteristikaene for molekylet blive beskrevet i nærvær eller ej af den pågældende gas..
Hvad er hæmoglobin til?
Hæmoglobin er nødvendigt for at transportere ilt til vævene i den mængde og hastighed, som disse berettiger, i betragtning af at ilt har så lidt opløselighed i blodet, at dets transport ved diffusion ville være utilstrækkelig til at dække vævets behov.
Hvordan er et hæmoglobinmolekyle?
Hæmoglobin er et tetramert protein (som har fire underenheder), har en sfærisk form og en molekylvægt på 64 kDa.
Dets fire underenheder udgør en enkelt funktionel enhed, hvor hver enkelt gensidig påvirker den anden. Hver underenhed består af en polypeptidkæde, globin og en protesegruppe, hæm- eller "hæm" -gruppen, der fungerer som en kofaktor og ikke består af aminosyrer; det vil sige, det er ikke protein i naturen.
Globin findes i to former: alfa-globin og beta-globin. Hæmoglobintetrameren består af et par alfa-globinkæder (på 141 aminosyrer) og et par beta-globinkæder (på 146 aminosyrer).
Hver af de fire polypeptidkæder er bundet til en hæmgruppe, som har et jernatom i midten i jernholdig tilstand (Fe2 +).
Hvordan er hæm-gruppen?
Hæmgruppen er en porphyrinring, der består af fire pyrrolringe (heterocykliske aromatiske forbindelser med formlen C4H5N) forbundet med methylbroer. Jernet i jernholdig tilstand, der er i centrum, er fastgjort til strukturen gennem koordinerede nitrogenbindinger.
Hver hæmgruppe er i stand til at binde til et iltmolekyle, så hvert hæmoglobinmolekyle kan kun binde 4 molekyler af gassen.
Den menneskelige krop indeholder ca. 2,5 x 1013 erythrocytter, som er de blodlegemer, der danner og transporterer hæmoglobin. Hver erytrocyt har ca. 280 millioner hæmoglobinmolekyler og kan derefter bære mere end 1 milliard iltmolekyler.
Hvordan dannes oxyhemoglobin?
Oxyhemoglobin dannes efter forening af et oxygenatom til hvert jernatom i den jernholdige tilstand, der findes i hver hæmgruppe i hæmoglobinmolekylet.
Udtrykket oxyhemoglobin henviser derefter til et iltet og ikke kemisk oxideret hæmoglobin, da det ikke mister en elektron, når det kombineres med ilt, og jern forbliver i jernholdig tilstand..
Oxygenering frembringer en ændring i molekylets kvaternære struktur, det vil sige en ændring i konformation, der kan overføres fra globinkæderne til hemgruppen og omvendt..
Hvad er den maksimale mængde ilt, som hæmoglobin kan bære?
Hæmoglobin kan højst binde fire iltmolekyler i sin struktur. Hvis det molære volumen af ideelle gasser er 22,4 l / mol, binder en mol hæmoglobin (64.500 g) med 89,6 liter ilt (4 mol O2 x 22,4 l / mol).
Så hvert gram hæmoglobin skal binde 1,39 ml O2 for at være 100% mættet (89,6 l / 64500 g x (1000 ml / l)).
I praksis giver blodprøver lidt lavere resultater, da der er små mængder methemoglobin (oxideret hæmoglobin) og carboxyhæmoglobin (hæmoglobin + kulilte (CO)), der ikke kan binde ilt.
Under hensyntagen til dette fastslår "Hüfner" -reglen, at 1 g hæmoglobin i blodet har en maksimal kapacitet til at binde ilt på 1,34 ml.
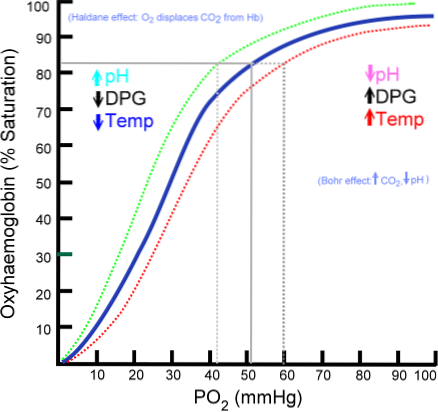
Oxyhemoglobin-bindingskurve
Antallet af iltmolekyler, der kan binde til et hæmoglobinmolekyle, afhænger af iltpartiet eller PO2. I fravær af ilt deoxygeneres, men når PO2 øges, øges antallet af oxygener, der binder til hæmoglobin..
Processen med at binde ilt til hæmoglobin afhængigt af iltens delvise tryk. Når det er tegnet, kaldes resultatet "oxyhemoglobin-kurven" og har en karakteristisk 'S' eller sigmoid form..
Afhængigt af PO2 vil hæmoglobin være mindre eller mere i stand til at "frigive" eller "levere" det ilt, det bærer, såvel som at blive fyldt med det..
For eksempel opnås den stejleste del af kurven i området mellem 10 og 60 mmHg tryk. I denne tilstand kan hæmoglobin let opgive store mængder O2. Dette er den tilstand, der opnås i vævene.
Når PO2 er mellem 90 og 100 mmHg (12 til 13 kPa), er hæmoglobin næsten 100% mættet med O2; og når arteriel PO2 er 60 mmHg (8 kPa), er O2-mætning stadig så høj som 90%.
I lungerne er det de betingelser, der er fremherskende (tryk mellem 60 og 100 mmHg), og det er dette, der gør det muligt at oplade hæmoglobinmolekylerne i erytrocytterne med ilt..
Denne sigmoidform, der trækker oxyhemoglobinkurven, sikrer, at dette protein opfører sig som en fremragende lungelæsser, en meget effektiv transportør i arterielt blod og en fremragende O2-donor i væv i forhold til den lokale metaboliske hastighed. Det vil sige efter behov.
Referencer
- Fox, S. I. (2006). Human Physiology 9. udgave (s. 501-502). McGraw-Hill presse, New York, USA.
- Murray, R. K., Granner, D. K., Mayes, P. A., og Rodwell, V. W. (2014). Harpers illustrerede biokemi. McGraw-Hill.
- Rawn, J. D. (1998). Biokemi (1989). Burlington, North Carolina: Neil Patterson Publishers (c) N. Lalioti, CP Raptopoulou, A. Terzis, A. Panagiotopoulos, SP Perlepes, E. Manessi-Zoupa, J. Chem. Soc. Dalton Trans., 1327.
- Robert M. Berne, Matthew N. Levy. (2001) Fysiologi. (3. udgave) Ediciones Harcourt, S.A.
- West, J. B. (1991). Fysiologisk grundlag for medicinsk praksis. Williams & Wilkins


Endnu ingen kommentarer