
Colligative egenskaber (med formler)
Det kolligativ ejendom er en hvilken som helst egenskab ved et stof, der afhænger af, eller varierer alt efter, antallet af partikler, der er til stede i det (i form af molekyler eller atomer), uden at det afhænger af arten af disse partikler.
Med andre ord kan disse også forklares som egenskaber af opløsninger, der afhænger af forholdet mellem antallet af opløste partikler og antallet af opløsningsmiddelpartikler. Dette koncept blev introduceret i 1891 af den tyske kemiker Wilhelm Ostwald, der klassificerede opløste egenskaber i tre kategorier.

Disse kategorier proklamerede, at kolligative egenskaber udelukkende afhang af koncentrationen og temperaturen af det opløste stof og ikke af arten af dets partikler..
Yderligere afhængede additive egenskaber, såsom masse, af sammensætningen af det opløste stof, og de konstitutionelle egenskaber mere af den opløste opløsnings molekylære struktur..
Artikelindeks
- 1 Colligative egenskaber
- 1.1 Fald i damptryk
- 1.2 Forøgelse af kogetemperaturen
- 1.3 Sænkning af frysetemperaturen
- 1.4 Osmotisk tryk
- 2 Referencer
Colligative egenskaber
De kolligative egenskaber undersøges hovedsageligt for fortyndede opløsninger (på grund af deres næsten ideelle opførsel) og er som følger:
Fald i damptryk
Det kan siges, at damptrykket i en væske er ligevægtstrykket i de dampmolekyler, som væsken er i kontakt med.
Ligeledes er forholdet mellem disse tryk forklaret med Raoults lov, der udtrykker, at et komponents partialtryk er lig med produktet af molfraktionen af komponenten ved komponentens damptryk i sin rene tilstand:
PTIL = XTIL . PºTIL
I dette udtryk:
PTIL = Delvist damptryk af komponent A i blandingen.
xTIL = Molfraktion af komponent A.
PºTIL= Damptryk af ren komponent A.
I tilfælde af faldet i et opløsningsmiddels damptryk sker dette, når der tilsættes en ikke-flygtig opløsningsmiddel til dannelse af en opløsning. Som det er kendt og pr. Definition har et ikke-flygtigt stof ikke en tendens til at fordampe.
Af denne grund, jo mere af dette opløste stof sættes til det flygtige opløsningsmiddel, jo lavere vil damptrykket være, og jo mindre opløsningsmiddel kan undslippe og blive en gasformig tilstand..
Så når opløsningsmidlet fordamper naturligt eller med magt, forbliver en mængde opløsningsmiddel endelig uden at fordampe sammen med den ikke-flygtige opløsningsmiddel..
Dette fænomen kan bedre forklares med begrebet entropi: når molekylerne foretager en overgang fra den flydende fase til gasfasen, stiger systemets entropi..
Dette betyder, at entropien i denne gasfase altid vil være større end den i flydende tilstand, fordi gasmolekylerne optager et større volumen..
Derefter, hvis entropien af den flydende tilstand øges ved fortynding, selvom den er knyttet til et opløst stof, falder forskellen mellem de to systemer. Af denne grund mindsker faldet i entropi også damptrykket..
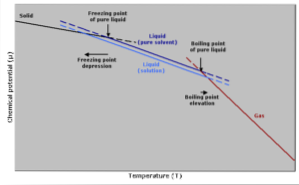
Kogende temperaturstigning
Kogepunktet er den temperatur, hvor der er ligevægt mellem væske- og gasfaserne. På dette tidspunkt er antallet af gasmolekyler, der bliver flydende (kondenserende), lig med antallet af flydende molekyler, der fordamper til gas..
Tilsætningen af en opløsningsmiddel får koncentrationen af flydende molekyler til at fortynde, hvilket får fordampningshastigheden til at falde. Dette genererer en ændring i kogepunktet for at kompensere for ændringen i opløsningsmiddelkoncentration..
Med andre enklere ord er kogetemperaturen for en opløsning højere end opløsningsmidlets i sin rene tilstand. Dette udtrykkes ved et matematisk udtryk vist nedenfor:
ATb = i. Kb . m
I dette udtryk:
ATb = Tb (opløsning) - Tb (opløsningsmiddel) = Variation i kogetemperatur.
i = van't Hoff-faktor.
Kb = Opløsningsmidlets kogekonstant (0,512 ºC / molal for vand).
m = molalitet (mol / kg).
Frysende temperaturreduktion
Frysetemperaturen for et rent opløsningsmiddel vil falde, når en mængde opløst stof tilsættes, da det påvirkes af det samme fænomen, at damptrykket falder..
Dette sker, fordi der ved en reduktion af dampen af opløsningsmidlet ved fortynding af et opløst stof kræves en lavere temperatur for at fryse det..
Naturen af fryseprocessen kan også tages i betragtning for at forklare dette fænomen: For at en væske skal fryse, skal den nå en ordnet tilstand, hvor den ender med at danne krystaller..
Hvis der er urenheder i væsken i form af opløste stoffer, vil væsken være mindre ordnet. Af denne grund vil opløsningen have større vanskeligheder med at fryse end et opløsningsmiddel uden urenheder..
Denne reduktion udtrykkes som:
ATF = -i. KF . m
I ovenstående udtryk:
ATF = TF (opløsning) - TF (opløsningsmiddel) = Frysningstemperaturvariation.
i = van't Hoff-faktor.
KF = Frysningskonstant for opløsningsmidlet (1,86 ºC kg / mol for vand).
m = molalitet (mol / kg).
Osmotisk tryk
Processen kendt som osmose er tendensen for et opløsningsmiddel til at passere gennem en semipermeabel membran fra en opløsning til en anden (eller fra et rent opløsningsmiddel til en opløsning).
Denne membran repræsenterer en barriere, hvorigennem nogle stoffer kan passere, og andre ikke, som i tilfælde af semipermeable membraner i cellevæggene i dyre- og planteceller..
Osmotisk tryk defineres derefter som det mindste tryk, der skal anvendes på en opløsning for at stoppe passagen af dets rene opløsningsmiddel gennem en semipermeabel membran..
Det er også kendt som målet for en opløsnings tendens til at modtage det rene opløsningsmiddel på grund af effekten af osmose. Denne egenskab er kolligativ, da den afhænger af koncentrationen af opløst stof i opløsningen, der udtrykkes som et matematisk udtryk:
Π. V = n. R. T, eller også π = M. R. T
I disse udtryk:
n = antal mol partikler i opløsningen.
R = Universal gaskonstant (8.314472 J. K-1 . muldvarp-1).
T = temperatur i Kelvin.
M = molaritet.
Referencer
- Wikipedia. (s.f.). Colligative egenskaber. Hentet fra en.wikipedia.org
- F.Kr. (s.f.). Colligative egenskaber. Gendannet fra opentextbc.ca
- Bosma, W. B. (s.f.). Colligative egenskaber. Hentet fra chemistryexplained.com
- Barknoter. (s.f.). Colligative egenskaber. Gendannet fra sparknotes.com
- University, F. S. (s.f.). Colligative egenskaber. Hentet fra chem.fsu.edu


Endnu ingen kommentarer