
Triple point
Hvad er det tredobbelte punkt?
Det tredobbelt punkt er et udtryk inden for termodynamik, der refererer til temperaturen og trykket, hvor tre faser af et stof eksisterer samtidigt i en tilstand af termodynamisk ligevægt. Dette punkt findes for alle stoffer, selvom de betingelser, hvorunder de opnås, varierer enormt mellem hver enkelt..
Et tredobbelt punkt kan også involvere mere end en fase af samme type for et bestemt stof; to forskellige faste, væske- eller gasfaser observeres. Helium, især isotopen helium-4, er et godt eksempel på et tredobbelt punkt, der involverer to individuelle væskefaser: normal væske og superfluid..
Hvad er det til, og hvornår bruges det tredobbelte punkt?
Vandets tredobbelte punkt bruges til at definere kelvin, basisenheden for termodynamisk temperatur i det internationale enhedssystem (SI). Denne værdi indstilles pr. Definition snarere end målt..
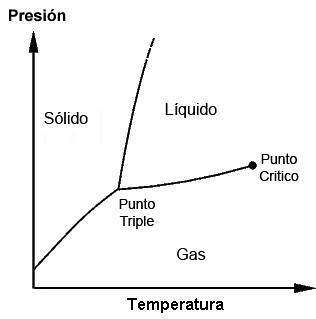
De tredobbelte punkter for hvert stof kan observeres ved hjælp af fasediagrammer, der er afbildede grafer, der gør det muligt at demonstrere de begrænsende betingelser for et stofs faste, flydende, gasformige faser (og andre, i særlige tilfælde), mens det udøves ændringer i temperatur, tryk og / eller opløselighed.
Et stof kan findes ved dets smeltepunkt, hvor fast stof møder væske; det kan også findes ved kogepunktet, hvor væske møder gas. Det er imidlertid ved det tredobbelte punkt, at de tre faser opnås. Disse diagrammer vil være forskellige for hvert stof, som det vil blive set senere.
Triple point kan bruges effektivt i termometer kalibrering, ved hjælp af triple point celler.
Dette er prøver af stoffer under isolerede forhold (inde i glas "celler"), der er i deres tredobbelte punkt med kendte temperatur- og trykforhold, og letter således studiet af præcisionen af termometermålingerne..
Undersøgelsen af dette koncept er også blevet brugt i udforskningen af planeten Mars, hvor man forsøgte at kende havniveauet under missioner, der blev udført i 1970'erne..
Tredobbelt vandpunkt

De nøjagtige betingelser for tryk og temperatur, hvor vand sameksisterer i sine tre faser i ligevægt - flydende vand, is og damp - forekommer ved en temperatur på nøjagtigt 273,16 K (0,01 ºC) og et partielt damptryk på 611.656 pascal (0.00603659 atm).
På dette tidspunkt er omdannelsen af stoffet til en af de tre faser mulig med minimale ændringer i dets temperatur eller tryk. Selv om systemets samlede tryk kunne være over det, der kræves for tredobbelt punkt, når systemet det delvise damptryk er på 611.656 Pa, når systemet tredobbelt punkt på samme måde..
Det er muligt at observere i den foregående figur repræsentationen af det tredobbelte punkt (eller tredobbelt punkt, på engelsk) af et stof, hvis diagram ligner vandets, i henhold til den temperatur og det tryk, der kræves for at nå denne værdi.
I tilfælde af vand svarer dette punkt til det mindste tryk, hvor flydende vand kan eksistere. Ved tryk mindre end dette tredobbelte punkt (for eksempel i vakuum) og når der anvendes opvarmning med konstant tryk, vil fast is konvertere direkte til vanddamp uden at passere gennem væske; dette er en proces kaldet sublimering.
Ud over dette minimumstryk (Ptp), smelter isen først til dannelse af flydende vand, og først derefter vil den fordampe eller koge for at danne damp.
For mange stoffer er temperaturværdien ved sit tredobbelte punkt den mindste temperatur, hvor væskefasen kan eksistere, men dette sker ikke i tilfælde af vand. For vand sker dette ikke, da smeltepunktet for is falder som en funktion af tryk, som vist med den grønne stiplede linje i den foregående figur..
I højtryksfaser har vandet et ret komplekst fasediagram, hvor femten kendte isfaser er vist (ved forskellige temperaturer og tryk) ud over ti forskellige tredobbelte punkter, der er visualiseret i følgende figur:
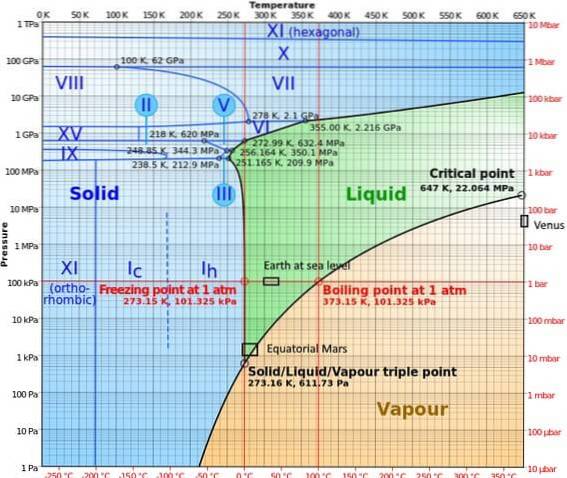
Det kan bemærkes, at der under højtryksforhold kan eksistere is i ligevægt med væsken; diagrammet viser, at smeltepunkter stiger med tryk. Ved konstante lave temperaturer og stigende tryk kan dampen omdannes direkte til is uden at passere gennem væskefasen..
De forskellige forhold, der opstår på planeterne, hvor tredobbeltpunktet er blevet undersøgt (Jorden ved havoverfladen og i Mars ækvatoriale zone) er også repræsenteret i dette diagram..
Diagrammet gør det klart, at det tredobbelte punkt varierer afhængigt af placeringen på grund af atmosfærisk tryk og temperatur og ikke kun på grund af eksperimentets indgriben..
Cyclohexan tredobbelt punkt
Cyclohexan er en cycloalkan, der har molekylformlen C6H12. Dette stof har den særlige karakter at have tredobbelte punktbetingelser, der let kan reproduceres, som i tilfældet med vand, da dette punkt er placeret ved en temperatur på 279,47 K og et tryk på 5,388 kPa.
Under disse betingelser er forbindelsen observeret kogende, størknet og smeltet med minimale ændringer i temperatur og tryk..
Benzen tredobbelt punkt
I et tilfælde svarende til cyclohexan benzen (en organisk forbindelse med den kemiske formel C6H6) har betingelser med tredobbelt punkt, der let kan reproduceres i et laboratorium.
Dens værdier er 278,5 K og 4,83 kPa, så eksperimentering med denne komponent på begynderniveau er også almindelig..
Referencer
- Wikipedia. (s.f.). Wikipedia. Hentet fra en.wikipedia.org
- Britannica, E. (1998). Encyclopedia Britannica. Hentet fra britannica.com
- Strøm, N. (s.f.). Atomkraft. Hentet fra nuclear-power.net
- Wagner, W., Saul, A., & Prub, A. (1992). Internationale ligninger for trykket langs smeltningen og langs sublimeringskurven for almindeligt vand. Bochum.
- Penoncello, S. G., Jacobsen, R. T., og Goodwin, A. R. (1995). En termodynamisk egenskabsformulering for cyclohexan.


Endnu ingen kommentarer