
Hvad er ækvivalenspunktet, og hvad er det til?
Det ækvivalenspunkt Det er en, hvor to kemiske stoffer har reageret fuldstændigt. I syre-basereaktioner indikerer dette punkt, når en hel syre eller base er blevet neutraliseret. Dette koncept er det daglige brød af titreringen eller volumetriske værdiansættelser og bestemmes ved hjælp af enkle matematiske beregninger.
Men hvad er graden? Det er en proces, hvor et volumen af en opløsning med kendt koncentration, kaldet titrerende, omhyggeligt tilsættes til en opløsning med ukendt koncentration for at opnå dens koncentration.

Brug af en pH-indikator gør det muligt at kende det øjeblik, hvor titrering slutter. Indikatoren føjes til den opløsning, der titreres for at foretage kvantificeringen af den koncentration, som det ønskes at kende. En syre-base indikator er en kemisk forbindelse, hvis farve afhænger af brintkoncentrationen eller pH i mediet..
Imidlertid indikerer farveskiftet på indikatoren slutpunktet for titreringen, men ikke ækvivalenspunktet. Ideelt set bør begge punkter falde sammen; men i virkeligheden kan farveændringen forekomme inden for få dråber, efter at neutraliseringen af syren eller basen er afsluttet..
Artikelindeks
- 1 Hvad er ækvivalenspunktet?
- 1.1 Slutpunkt
- 2 Ækvivalenspunkt for titrering af en stærk syre med en stærk base
- 3 Svag syrestærk basetitreringskurve
- 3.1 Stadier
- 3.2 Valg af indikator i henhold til ækvivalenspunktet
- 4 Referencer
Hvad er ækvivalenspunktet?
En opløsning af en syre med ukendt koncentration anbragt i en kolbe kan titreres ved langsomt at tilsætte en natriumhydroxidopløsning med kendt koncentration ved anvendelse af en burette..
Valg af en indikator skal udføres på en sådan måde, at den skifter farve på det punkt, hvor den samme mængde kemiske ækvivalenter af titreringsopløsningen og opløsningen med ukendt koncentration har reageret..
Dette er ækvivalenspunktet, mens det punkt, hvor en indikator skifter farve, kaldes slutpunktet, hvor titreringen slutter..
Sidste punkt
Ionisering eller dissociation af indikatoren er repræsenteret som følger:
HIn + HtoELLER <=> I- + H3ELLER+
Og har derfor en konstant Ka
Ka = [H3ELLER+] [I-] / [HIn]
Forholdet mellem den ikke-dissocierede indikator (HIN) og den dissocierede indikator (In-) bestemmer indikatorens farve.
Tilsætningen af en syre øger HIN-koncentrationen og frembringer indikatorfarve 1. I mellemtiden favoriserer tilføjelsen af en base en stigning i koncentrationen af den dissocierede indikator (In-) (farve 2).
Det er ønskeligt, at ækvivalenspunktet svarer til slutpunktet. For at gøre dette vælges en indikator med et farveændringsinterval, der inkluderer ækvivalenspunktet. Derudover forsøger det at reducere eventuelle fejl, der producerer en forskel mellem ækvivalenspunktet og slutpunktet.
Standardisering eller titrering af en opløsning er en proces, hvor den nøjagtige koncentration af en opløsning bestemmes. Det er metodisk en grad, men den fulgte strategi er anderledes.
En opløsning af den primære standard anbringes i kolben, og titreringsopløsningen, der standardiseres, tilsættes med en buret..
Ækvivalenspunkt for titrering af en stærk syre med en stærk base
100 ml 0,1 M HCI anbringes i kolben, og en 0,1 M NaOH-opløsning tilsættes gradvist gennem en burette til bestemmelse af pH-ændringer i den opløsning, der stammer fra saltsyren.
Først før tilsætning af NaOH er HCI-opløsningens pH 1.
Den stærke base (NaOH) tilsættes, og pH stiger gradvist, men det er stadig en sur pH, da overskydende syre bestemmer denne pH.
Hvis du fortsætter med at tilføje NaOH, kommer der et tidspunkt, hvor ækvivalenspunktet er nået, hvor pH er neutral (pH = 7). Syren har reageret med basen, der er forbrugt, men der er endnu ikke overskydende base.
Koncentrationen af natriumchlorid, som er et neutralt salt (eller Na+ ej heller Cl- hydrolyse).
Hvis du fortsætter med at tilføje NaOH, fortsætter pH-værdien med at stige og bliver mere basisk end ækvivalenspunktet, fordi koncentrationen af NaOH dominerer..
Ideelt set bør indikatorens farveændring forekomme ved pH = 7; men på grund af titreringskurvens skarpe form kan phenolphthalein anvendes, som skifter til en lyserød farve ved en pH omkring 8.
Svag syrestærk basetitreringskurve
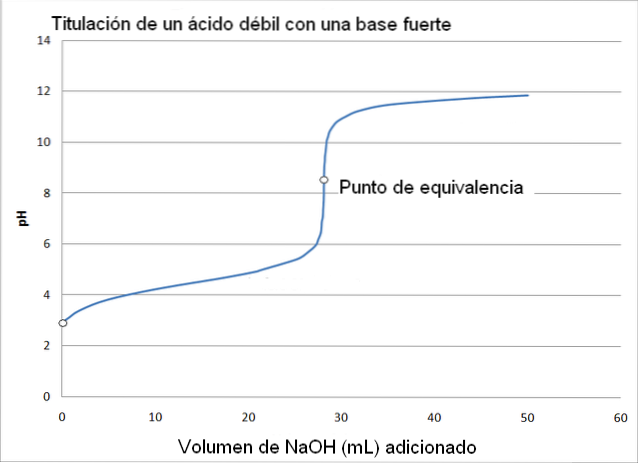
I dette tilfælde er en svag syre, såsom eddikesyre (CH3COOH) med en stærk base, natriumhydroxid (NaOH). Den reaktion, der forekommer i titreringen, kan skitseres som følger:
NaOH + CH3COOH => CH3COO-Na+ + HtoELLER
I dette tilfælde dannes acetatbufferen med en pKa = 4,74. Det bufrede område kan ses i den lille og næsten umærkelige ændring før pH 6.
Ækvivalenspunktet er, som billedet indikerer, omkring 8,72 og ikke 7. Hvorfor? Fordi CH3COO- er en anion, der efter hydrolysering genererer OH-, som baserer pH:
CH3COO- + HtoELLER <=> CH3COOH + OH-
Niveauer
Titrering af eddikesyre med natriumhydroxid kan opdeles i 4 trin til analyse.
-Før man begynder at tilsætte basen (NaOH), er opløsningens pH sur og afhænger af dissociationen af eddikesyre.
-Når natriumhydroxid tilsættes, dannes acetatbufferopløsningen, men på samme måde øges dannelsen af acetatkonjugatbasen, hvilket medfører en stigning i opløsningens pH..
-Ækvivalenspunktet pH forekommer ved en pH på 8,72, som helt ærligt er basisk..
Ækvivalenspunktet har ikke en konstant værdi og varierer afhængigt af de forbindelser, der er involveret i titreringen..
-Når du fortsætter med at tilføje NaOH, når du har nået ækvivalenspunktet, stiger pH på grund af et overskud af natriumhydroxid.
Valg af indikator i henhold til ækvivalenspunktet
Phenolphthalein er nyttigt til bestemmelse af ækvivalenspunktet i denne titrering, fordi det har sit farvedrejepunkt ved en pH omkring 8, der falder i pH-zonen for eddikesyretitrering, der inkluderer punktækvivalensen (pH = 8,72).
På den anden side er methylrød ikke nyttig til bestemmelse af ækvivalenspunktet, da det ændrer farve i pH-området fra 4,5 til 6,4.
Referencer
- Wikipedia. (2018). Ækvivalenspunkt. Gendannet fra: es.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22. juni 2018). Definition af ækvivalenspunkt. Gendannet fra: thoughtco.com
- Lusi Madisha. (16. april 2018). Forskellen mellem endepunkt og ækvivalenspunkt. " DifferenceBetween.net. Gendannet fra: differencebetween.net
- Se J. (2018). Ækvivalenspunkt: Definition og beregning. Gendannet fra: study.com
- Whitten, K. W., Davis, R. E., Peck, L. P. & Stanley, G. G. Chemistry. (2008) Ottende udgave. Cengage Learning Editors.



Endnu ingen kommentarer