
Hvad er en fortyndet opløsning? faktorer og eksempler
EN fortyndet opløsning eller umættetDet er en kemisk opløsning, der ikke har nået den maksimale koncentration af opløst stof opløst i et opløsningsmiddel. Den yderligere opløste opløsning opløses, når den tilsættes til en fortyndet opløsning og vises ikke i den vandige fase..
Fra et fysisk-kemisk synspunkt betragtes en umættet opløsning som en tilstand af dynamisk ligevægt, hvor de hastigheder, hvormed opløsningsmidlet opløser det opløste stof, er større end hastigheden for omkrystallisation..
Et eksempel på en fortyndet opløsning er illustreret i figur 1. I figur 1.1, 1.2 og 1.3 er der et konstant volumen vand i bægerglasset.
I figur 1.1 begynder processen, hvor det opløste stof begynder at opløses, repræsenteret af de røde pile. I dette tilfælde ses to faser, en væske og et fast stof.
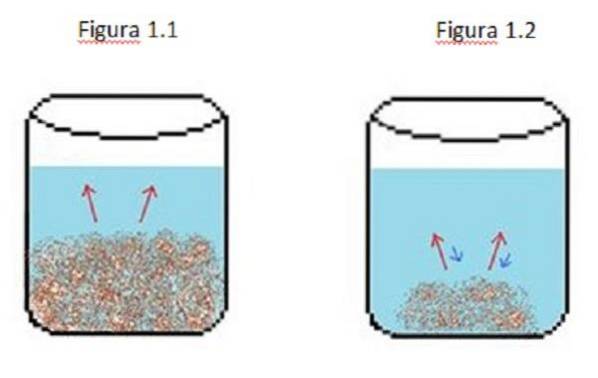
I figur 1.2 er meget af det faste stof opløst, men ikke fuldstændigt på grund af omkrystallisationsprocessen, repræsenteret af de blå pile..
I dette tilfælde er de røde pile større end de blå pile, hvilket betyder at fortyndingshastigheden er større end omkrystallisationshastigheden. På dette tidspunkt har du en umættet opløsning.
Således kan vi sige, at en fortyndet opløsning kan opløse mere opløst i den, indtil den når mætningspunktet. Ved mætningspunktet opløses ikke mere opløst stof i opløsningsmidlet, og en sådan opløsning kaldes en mættet opløsning..
På denne måde er opløsningerne oprindeligt umættede i naturen og bliver til sidst mættede opløsninger ved tilsætning af opløst stof i den..
Hvad er en fortyndet opløsning?
En fortyndet opløsning er den umættede, mættede eller overmættede opløsning, hvortil der tilsættes mere opløsningsmiddel. Resultatet er en umættet opløsning med lavere koncentration.
Fortyndinger er en almindelig proces i et kemisk laboratorium. Generelt arbejder du med fortyndede løsninger, der er lavet af lagerløsninger, der er dem, der købes direkte fra en bestemt forhandler.
For at fremstille fortyndingerne anvendes formlen C1V1= CtoVto hvor C er koncentrationen af opløsningen, generelt med hensyn til molaritet eller normalitet. V er opløsningens volumen i ml, og udtryk 1 og 2 svarer til henholdsvis de koncentrerede og fortyndede opløsninger.
Faktorer, der påvirker opløselighed
Mængden af opløst stof, der kan opløses i et opløsningsmiddel, afhænger af forskellige faktorer, blandt dem de vigtigste er:
1- Temperatur
Opløselighed stiger med temperaturen. For eksempel kan mere salt opløses i varmt vand end i koldt vand..
Der kan dog være undtagelser, f.eks. Falder gassernes opløselighed i vand med stigende temperatur..
I dette tilfælde modtager de opløste molekyler kinetisk energi, når de opvarmes, hvilket letter deres flugt..
2- Tryk
Øget tryk kan tvinge opløsning af opløst stof. Dette bruges ofte til at opløse gasser i væsker..
3- Kemisk sammensætning
Opløselighedens art og opløsningen og tilstedeværelsen af andre kemiske forbindelser i opløsningen påvirker opløseligheden..
For eksempel kan mere sukker opløses i vand end salt i vand. I dette tilfælde siges det, at sukker er mere opløseligt.
Ethanol og vand er fuldstændigt opløselige med hinanden. I dette særlige tilfælde vil opløsningsmidlet være den forbindelse, der findes i den største mængde.
4- Mekaniske faktorer
I modsætning til opløsningshastigheden, som hovedsageligt afhænger af temperaturen, afhænger omkrystallisationshastigheden af den opløste koncentration på overfladen af krystalgitteret, hvilket foretrækkes, når en opløsning er ubevægelig.
Omrøring af opløsningen forhindrer derfor denne ophobning og maksimerer opløsning..
Mætning og opløselighedskurver
Opløselighedskurverne er en grafisk database, hvor mængden af opløst stof, der opløses i en mængde opløsningsmiddel, sammenlignes ved en bestemt temperatur.
Opløselighedskurver plottes almindeligvis for en mængde opløst stof, enten fast eller gas, i 100 gram vand. Mætningskurver for forskellige opløste stoffer i vand er illustreret i figur 2..
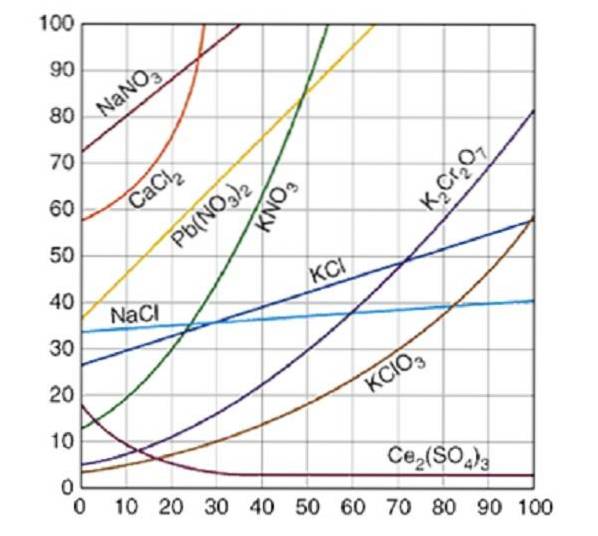
Kurven angiver mætningspunktet ved en given temperatur. Området under kurven indikerer, at du har en umættet opløsning, og at der derfor kan tilsættes mere opløst stof. I området over kurven er der en overmættet opløsning.
Idet man tager natriumchlorid (NaCl) som et eksempel, ved 25 grader Celsius kan ca. 35 gram NaCl opløses i 100 gram vand for at opnå en mættet opløsning.
Eksempler på fortyndede opløsninger
Umættede løsninger kan findes dagligt, det er ikke nødvendigt at være i et kemisk laboratorium.
Opløsningsmidlet behøver ikke nødvendigvis at være vand. Nedenfor er hverdagseksempler på fortyndede løsninger:
- Tilføjelse af en spiseskefuld sukker til en kop varm kaffe producerer en umættet sukkeropløsning.
- Eddike er en fortyndet opløsning af eddikesyre i vand.
- Tåge er en umættet (men tæt på mættet) opløsning af vanddamp i luften.
- 0,01 M HCI er en umættet opløsning af saltsyre i vand.
- Gnidningsalkohol er en fortyndet opløsning af isopropylalkohol i vand.
- Suppen er en umættet opløsning af vand og natriumchlorid.
- Alkoholholdige drikkevarer er fortyndede opløsninger af ethanol og vand. Normalt vises den procentdel af alkohol, de har.
Referencer
- Anne Marie Helmenstine, P. (2016, 7. juli). Mættet opløsning Definition og eksempler. Gendannet fra about.com.
- Cambrige Universitet. (s.f.). Opløselighedskurver. Gendannet fra dynamicscience.com.au.
- Eksempler på mættet opløsning. (s.f.). Gendannet fra eksempler.yourdcitionary.com.
- J., S. (2014, 4. juni). Mættede og overmættede løsninger. Gendannet fra socratic.org.
- James, N. (s.f.). Mættet løsning: Definition og eksempler. Gendannet fra study.com.
- M., B. (2014, 14. oktober). Mættede og overmættede løsninger. Gendannet fra socratic.org.
- Opløselighedskurver. (s.f.). Gendannet fra kentchemistry.com.
- Mætningsrør. (2014, 26. juni). Gendannet fra chem.libretexts.org.



Endnu ingen kommentarer