
Karakteristiske kemiske reaktioner, dele, typer, eksempler

Det kemiske reaktioner De er ændringer, der betyder noget i arrangementet af dets atomer, og de finder sted, når to forskellige stoffer eller forbindelser kommer i kontakt. Ændringer stammer fra processen, der kan ses med det samme; såsom en stigning i temperatur, afkøling, gasdannelse, blink eller udfældning af et fast stof.
De mest almindelige kemiske reaktioner går ofte ubemærket hen i hverdagen; tusinder af dem udføres i vores kroppe. Andre er dog mere synlige, da vi kan fremstille dem i køkkenet ved at vælge de rigtige redskaber og ingredienser; for eksempel blanding af bagepulver med eddike, smeltning af sukker i vand eller forsuring af lilla kåljuice.

På laboratorier bliver kemiske reaktioner mere almindelige og almindelige; alle forekommer i bægerglas eller Erlenmeyer-kolber. Hvis de deler noget til fælles, er det, at ingen af dem er enkle, da de skjuler kollisioner, linkbrud, mekanismer, linkdannelse, energi og kinetiske aspekter..
Der er kemiske reaktioner så slående, at amatører og forskere, der kender reagensernes toksikologi og nogle sikkerhedsforanstaltninger, gengiver dem i store skalaer i fascinerende demonstrationsbegivenheder..
Artikelindeks
- 1 Begreb kemisk reaktion
- 2 Kendetegn ved kemiske reaktioner
- 2.1 Kinetik
- 2.2 Konservering af dej
- 2.3 Fysiske ændringer og / eller tilstandsændringer
- 2.4 Farvevariation
- 2.5 Frigivelse af gasser
- 2.6 Temperaturændringer
- 3 Dele af en kemisk reaktion
- 3.1 Reagenser og produkter
- 3.2 Reaktionsmedier
- 3.3 Fartøjer eller reaktorer
- 4 Typer af kemiske reaktioner
- 4.1 - Oxidationsreduktion (redox)
- 4.2 - Syntese
- 4.3 - Nedbrydning
- 4.4 - Forskydning
- 4.5 - Gasdannelse
- 4.6 - Metates eller dobbelt forskydning
- 5 Eksempler på kemiske reaktioner
- 5.1 Rulning
- 5.2 Neutralisering
- 5.3 Dobbeltrulning
- 5.4 Redox
- 6 Løst kemiske reaktioner øvelser
- 6.1 - Øvelse 1
- 6.2 - Øvelse 2
- 6.3 - Øvelse 3
- 7 Referencer
Kemisk reaktionskoncept
Kemiske reaktioner finder sted, når der brydes en binding (ionisk eller kovalent), således at en anden dannes i stedet for; to atomer eller et sæt af dem holder op med at interagere stærkt for at skabe nye molekyler. Takket være dette kan de kemiske egenskaber af en forbindelse, dens reaktivitet, stabilitet, med hvad den reagerer bestemmes.
Ud over at være ansvarlige for de kemiske reaktioner, der betyder noget konstant, uden at påvirke dets atomer, forklarer de fremkomsten af forbindelser, som vi kender dem..
Der kræves energi til at obligationer brydes, og når obligationer dannes frigives den. Hvis den absorberede energi er større end den frigivne, siges reaktionen at være endoterm; vi køler omgivelserne. Hvis den frigivne varme er højere end den absorberede, vil det være en exoterm reaktion; omgivelserne bliver varme.
Karakteristika for kemiske reaktioner

Kinetik
Molekylerne skal i teorien kollidere med hinanden og bære nok kinetisk energi til at fremme brydningen af en binding. Hvis deres kollisioner er langsomme eller ineffektive, påvirkes den kemiske reaktion kinetisk. Dette kan ske enten ved stoffernes fysiske tilstande eller ved deres geometri eller struktur..
Således transformeres stof i en reaktion ved at absorbere eller frigive varme, samtidig gennemgår det kollisioner, der favoriserer dannelsen af produkter; de vigtigste komponenter i enhver kemisk reaktion.
Opbevaring af dej
På grund af loven om bevarelse af masse forbliver den samlede masse af samlingen konstant efter en kemisk reaktion. Således er summen af de enkelte masser af hvert stof lig med massen af det opnåede resultat.
Fysiske ændringer og / eller tilstandsændringer
Forekomsten af en kemisk reaktion kan ledsages af en ændring i komponenternes tilstand; det vil sige en variation i materialets faste, flydende eller gasformige tilstand.
Imidlertid involverer ikke alle tilstandsændringer en kemisk reaktion. For eksempel: hvis vand fordamper på grund af varmen, er vanddampen, der produceres efter denne ændring af tilstanden, stadig vand.
Farvevariation
Blandt de fysiske egenskaber, der skyldes en kemisk reaktion, skiller sig ændringen i reagensernes farve i forhold til det færdige produkts farve ud..
Dette fænomen er mærkbart, når man observerer den kemiske reaktion af metaller med ilt: når et metal oxiderer, ændrer det sin karakteristiske farve (guld eller sølv, alt efter omstændighederne), for at gøre en rød-orange nuance, kendt som rust..
Frigivelse af gasser
Denne egenskab manifesteres som en boblende eller med udsendelse af bestemte lugte.
Generelt forekommer bobler som en konsekvens af udsættelse af en væske til høje temperaturer, hvilket tilskynder til en stigning i den kinetiske energi af de molekyler, der er en del af reaktionen..
Temperaturændringer
Hvis varme er en katalysator for den kemiske reaktion, vil en temperaturændring blive induceret i slutproduktet. Derfor kan indgang og udgang af varme i processen også være et kendetegn ved kemiske reaktioner..
Dele af en kemisk reaktion
Reagenser og produkter
Enhver kemisk reaktion er repræsenteret af en ligning af typen:
A + B → C + D
Hvor A og B er reaktanterne, mens C og D er produkterne. Ligningen fortæller os, at atomet eller molekylet A reagerer med B på oprindelsesprodukterne C og D. Dette er en irreversibel reaktion, da reaktanterne ikke kan stamme igen fra produkterne. På den anden side er reaktionen nedenfor reversibel:
A + B. <=> C + D
Det er vigtigt at understrege, at massen af reaktanterne (A + B) skal være lig med massen af produkterne (C + D). Ellers ville dejen ikke konserveres. På samme måde skal antallet af atomer for et givet element være det samme før og efter pilen.
Over pilen er nogle specifikke specifikationer for reaktionen angivet: temperatur (Δ), forekomst af ultraviolet stråling (hv) eller brugt katalysator.
Reaktionsmedier
Med hensyn til liv og reaktionerne i vores kroppe er reaktionsmediet vandigt (ac). Imidlertid kan kemiske reaktioner finde sted i ethvert flydende medium (ethanol, iseddikesyre, toluen, tetrahydrofuran osv.), Så længe reagenserne er godt opløst..
Fartøjer eller reaktorer
Kontrollerede kemiske reaktioner forekommer i en beholder, enten et simpelt glas eller i en reaktor af rustfrit stål.
Typer af kemiske reaktioner
Typerne af kemiske reaktioner er baseret på, hvad der sker på molekylært niveau; hvilke bindinger er brudt, og hvordan atomer ender med at slutte. Ligeledes tages det i betragtning, om arten vinder eller mister elektroner; selvom dette forekommer i de fleste kemiske reaktioner.
Her forklarer vi de forskellige typer kemiske reaktioner, der findes.
- Oxidationsreduktion (redox)
Kobberoxidation
I eksemplet med patina finder en oxidationsreaktion sted: metallisk kobber mister elektroner i nærvær af ilt for at omdanne til dets tilsvarende oxid.
4Cu (s) + Oto(g) => CutoDu)
Kobber (I) oxid fortsætter med at oxidere til kobber (II) oxid:
2CutoO (s) + Oto => 4CuO (s)
Denne type kemisk reaktion, hvor arterne øger eller reducerer deres antal (eller tilstand) af oxidation, er kendt som oxidation og reduktion (redox) reaktion..
Metallisk kobber med oxidationstilstand 0 mister først en elektron og derefter den anden (oxideres), mens ilt forbliver (reducerer):
Cu => Cu+ + og-
Cu+ => Cuto+ + og-
ELLERto + 2e- => 2Oto-
Forstærkning eller tab af elektroner kan bestemmes ved at beregne oxidationstal for atomer i de kemiske formler af deres resulterende forbindelser..
For CutoEller det vides, at fordi det er et oxid, har vi anionen Oto-, Derfor skal hvert af de to kobberatomer have en ladning på +1 for at holde ladningerne neutraliseret. Meget ens sker med CuO.
Når kobber oxiderer, får det positive oxidationsnumre; og ilt, der skal reduceres, negative oxidationstal.
Jern og kobolt
Yderligere eksempler på redoxreaktioner er vist nedenfor. Der vil også blive lavet en kort kommentar, og ændringerne i oxidationstal vil blive specificeret..
FeClto + CoCl3 => FeCl3 + CoClto
Hvis oxidationstallene beregnes, bemærkes det, at de af Cl forbliver med en konstant værdi på -1; ikke sådan med Fe y Co.
Ved første øjekast er jern blevet oxideret, mens kobolt er blevet reduceret. Hvordan ved du det? Fordi jern interagerer nu ikke med to Cl-anioner- men med tre er chloratomet (neutralt) mere elektronegativt end jern og cobalt. På den anden side sker det modsatte med kobolt: det går fra at interagere med tre Cl- to af dem.
Hvis ovenstående argumentation ikke er klar, fortsætter vi med at skrive de kemiske ligninger af nettoverførsel af elektroner:
Troto+ => Tro3+ + og-
Co3+ + og- => Coto+
Derfor er Feto+ ruster, mens Co3+ reduceres.
Jod og mangan
6KMnO4 + 5KI + 18HCl => 6MnClto + 5KIO3 + 6KCl + 9HtoELLER
Den kemiske ligning ovenfor kan virke kompliceret, men det er det ikke. Klor (Cl-) eller ilt (Oto-) oplever gevinst eller tab af deres elektroner. Jod og mangan, ja.
I betragtning af kun forbindelserne med jod og mangan har vi:
KI => KIO3 (oxidationsnummer: -1 til +5, mister seks elektroner)
KMnO4 => MnClto (oxidationsnummer: +7 til +2, få fem elektroner)
Jod oxideres, mens mangan reduceres. Hvordan ved man uden at foretage beregninger? Fordi jod går fra at være med kalium til at interagere med tre oxygener (mere elektronegative); og mangan mister på sin side interaktioner med ilt for at være med klor (mindre elektronegativ).
KI kan ikke miste seks elektroner, hvis KMnO4 vind fem; det er derfor, at antallet af elektroner skal afbalanceres i ligningen:
5 (KI => KIO3 + 6e-)
6 (KMnO4 + 5e- => MnClto)
Hvilket resulterer i en nettooverførsel på 30 elektroner.
Forbrænding
Forbrænding er en kraftig og energisk oxidation, hvor lys og varme frigives. Generelt deltager oxygen i denne type kemisk reaktion som et oxidations- eller oxidationsmiddel; mens reduktionsmidlet er brændstoffet, der brænder i slutningen af dagen.
Hvor der er aske, var der forbrænding. Disse er i det væsentlige sammensat af carbon og metaloxider; skønt dets sammensætning logisk afhænger af, hvad brændstoffet var. Nedenfor er nogle eksempler:
C (s) + Oto(g) => COto(g)
2CO (g) + Oto(g) => 2COto(g)
C3H8(g) + 5Oto(g) => 3COto(g) + 4HtoO (g)
Hver af disse ligninger svarer til komplette forbrændinger; al brændstof reagerer med et overskud af ilt for at garantere dets fuldstændige transformation.
Ligeledes skal det bemærkes, at COto og HtoEller er de vigtigste produkter gasformige, når kulstofholdige organer brænder (såsom træ, kulbrinter og animalsk væv). Det er uundgåeligt, at der dannes noget carbon-allotrop på grund af utilstrækkelig ilt såvel som mindre iltede gasser såsom CO og NO.
- Syntese
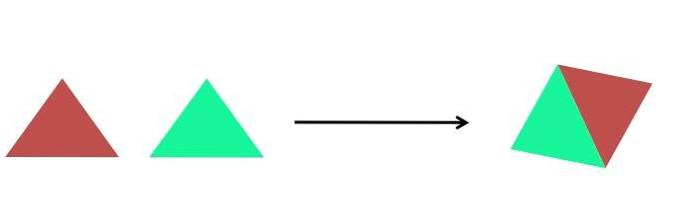
Ovenstående billede viser en ekstrem simpel gengivelse. Hver trekant er en forbindelse eller et atom, der forenes for at danne en enkelt forbindelse; to trekanter danner et parallelogram. Masserne øges, og de fysiske og kemiske egenskaber ved produktet er mange gange meget forskellige fra dets reagenser.
For eksempel frembringer forbrændingen af hydrogen (som også er en redoxreaktion) hydrogenoxid eller oxygenhydrid; bedre kendt som vand:
Hto(g) + Oto(g) => 2HtoO (g)
Når de to gasser blandes ved en høj temperatur, brænder de og producerer gasformigt vand. Efterhånden som temperaturen afkøles, kondenserer dampene til at give flydende vand. Flere forfattere betragter denne syntese-reaktion som et af de mulige alternativer til at erstatte fossile brændstoffer ved opnåelse af energi.
H-H- og O = O-bindingerne brydes for at danne to nye enkeltbindinger: H-O-H. Vand er som bekendt et unikt stof (ud over den romantiske forstand), og dets egenskaber er meget forskellige fra gasformigt brint og ilt..
Ioniske forbindelser
Dannelsen af ioniske forbindelser ud fra deres grundstoffer er også et eksempel på en syntesereaktion. En af de enkleste er dannelsen af metalhalogenider i gruppe 1 og 2. F.eks. Syntesen af calciumbromid:
Ca (s) + Brto(l) => CaBrto(s)
En generel ligning for denne type syntese er:
M (s) + Xto => MXto(s)
Samordning
Når den dannede forbindelse involverer et metalatom inden for en elektronisk geometri, siges det så, at det er et kompleks. I komplekser forbliver metaller bundet til ligander ved svage kovalente bindinger og dannes ved koordineringsreaktioner.
For eksempel har vi komplekset [Cr (NH3)6]3+. Dette dannes, når kationen Cr3+ er i nærvær af ammoniakmolekylerne, NH3, som fungerer som chromligander:
Cr3+ + 6NH3 => [Cr (NH3)6]3+
Den resulterende koordinationoktaeder over krommetallcentret er vist nedenfor:
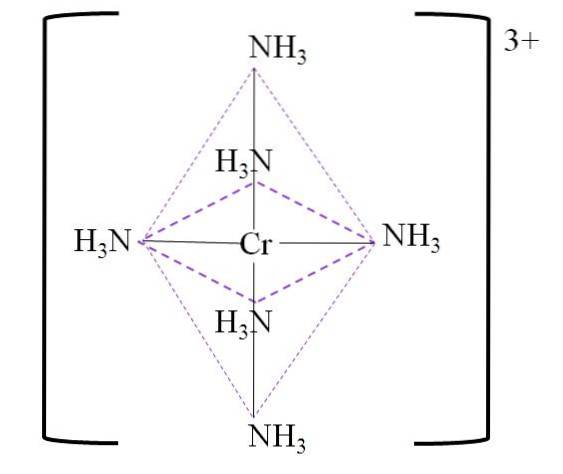
Bemærk, at 3+ ladningen på krom ikke neutraliseres i komplekset. Dens farve er lilla, og det er derfor, oktaeder er repræsenteret med den farve.
Nogle komplekser er mere interessante, som i tilfælde af visse enzymer, der koordinerer jern-, zink- og calciumatomer.
- Nedbrydning
Nedbrydning er det modsatte af syntese: en forbindelse nedbrydes i et, to eller tre grundstoffer eller forbindelser.
For eksempel har vi følgende tre nedbrydninger:
2HgO (s) => 2Hg (l) + Oto(g)
2HtoELLERto(l) => 2HtoO (l) + Oto(g)
HtoCO3(ac) => COto(g) + HtoO (l)
HgO er et rødligt fast stof, der under virkning af varme nedbrydes til metallisk kviksølv, en sort væske og ilt..
Hydrogenperoxid eller hydrogenperoxid gennemgår nedbrydning, hvilket giver flydende vand og ilt.
Og kulsyre nedbrydes på sin side til kuldioxid og flydende vand.
En "tørre" nedbrydning er den, der lider af metalliske carbonater:
Tyv3(s) => CaO (s) + COto(g)
Klasse vulkan

En nedbrydningsreaktion, der er blevet anvendt i kemiklasser, er den termiske nedbrydning af ammoniumdichromat (NH4)toCrtoELLER7. Dette kræftfremkaldende appelsinsalt (så det skal håndteres med stor omhu), brænder for at frigive en masse varme og producere et grønt fast, kromoxid, CrtoELLER3:
(NH4)toCrtoELLER7(s) => CrtoELLER3(s) + 4HtoO (g) + Nto(g)
- Forskydning
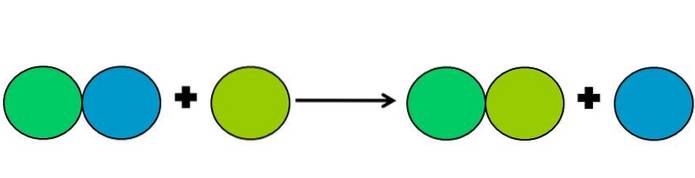
Forskydningsreaktioner er en type redoxreaktion, hvor det ene element fortrænger det andet i en forbindelse. Det fortrængte element ender med at reducere eller vinde elektroner.
For at forenkle ovenstående vises billedet ovenfor. Cirklerne repræsenterer et element. Det bemærkes, at den limegrønne cirkel fortrænger den blå og forbliver på ydersiden; men ikke kun det, men den blå cirkel krymper undervejs, og den limegrønne ruster.
Af brint
For eksempel har vi følgende kemiske ligninger til at afsløre ovenstående forklaret:
2Al (s) + 6HCl (aq) => AlCl3(aq) + 3Hto(g)
Zr (s) + 2HtoO (g) => ZrOto(s) + 2Hto(g)
Zn (s) + HtoSW4(ac) => ZnSO4(ac) + Hto(g)
Hvad er det fortrængte element for disse tre kemiske reaktioner? Brint, der reduceres til molekylært brint, Hto; den går fra et oxidationstal på +1 til 0. Bemærk at metallerne aluminium, zirconium og zink kan fortrænge hydrogenerne fra syrer og vand; mens kobber, hverken sølv eller guld, ikke kan.
Af metaller og halogener
Ligeledes er der disse to yderligere fortrængningsreaktioner:
Zn (s) + CuSO4(ac) => Cu (s) + ZnSO4(ac)
Clto(g) + 2Nal (aq) => 2NaCl (aq) + Ito(s)
I den første reaktion fortrænger zink det mindre aktive metal kobber; zink oxideres, mens kobber reduceres.
I den anden reaktion fortrænger på den anden side chlor, et element, der er mere reaktivt end iod, sidstnævnte i natriumsaltet. Her er det omvendt: det mest reaktive element reduceres ved oxidering af det fortrængte element; derfor reduceres klor ved oxiderende iod.
- Gasdannelse
I reaktionerne kunne det ses, at flere af dem genererede gasser, og derfor går de også ind i denne type kemisk reaktion. Ligeledes betragtes reaktionerne i det forrige afsnit, som brintforskydning af et aktivt metal, som gasdannelsesreaktioner..
Ud over de allerede nævnte frigiver metalsulfider for eksempel hydrogensulfid (som lugter som rådne æg), når der tilsættes saltsyre:
NatoS (s) + 2HCl (aq) => 2NaCl (aq) + HtoS (g)
- Metates eller dobbelt forskydning
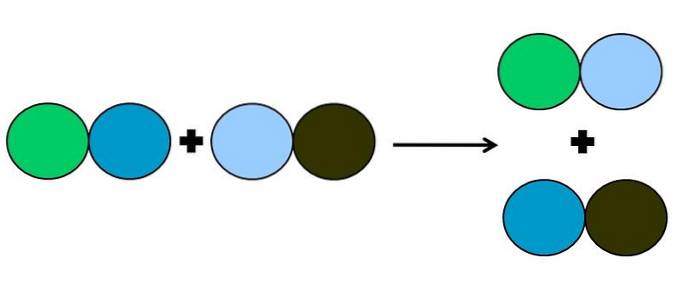
I metatesen eller dobbelt forskydningsreaktion er det, der sker, en ændring af partnere uden elektronoverførsler; det vil sige, det betragtes ikke som en redoxreaktion. Som det kan ses på billedet ovenfor, bryder den grønne cirkel linket med den mørkeblå cirkel for at linke til den lyseblå cirkel.
Nedbør
Når interaktionen mellem en af partnerne er stærk nok til at overvinde væskens opløsningseffekt, opnås et bundfald. Følgende kemiske ligninger repræsenterer udfældningsreaktioner:
AgNO3(aq) + NaCl (aq) => AgCl (s) + NaNO3(ac)
CaClto(ac) + NatoCO3(ac) => CaCO3(s) + 2NaCl (aq)
I den første reaktion blev Cl- skifter til NEJ3- til dannelse af sølvchlorid, AgCl, som er et hvidt bundfald. Og i den anden reaktion, CO3to- skifter til Cl- at udfælde calciumcarbonat.
Basesyre
Måske er den mest symbolske af metatesereaktionerne syrebasneutralisering. Endelig vises to syre-basereaktioner som eksempler:
HCI (aq) + NaOH (aq) => NaCl (aq) + HtoO (l)
2HCl (aq) + Ba (OH)to(ac) => BaClto(aq) + 2HtoO (l)
OH- fortrænge Cl- til dannelse af vand og chloridsalte.
Eksempler på kemiske reaktioner
Nedenfor og under nævnes nogle kemiske reaktioner med deres respektive ligninger og kommentarer..
Forskydning
Zn (s) + AgNO3(ac) → 2Ag (s) + Zn (NO3)to(ac)
Zink fortrænger sølv i sit nitratsalt: reducerer det fra Ag+ til Ag. Som et resultat begynder metallisk sølv at udfældes i mediet, observeret under mikroskopet som sølvfarvede træer uden blade. På den anden side kombineres nitrat med Zn-ionerto+ hvilket resulterer i dannelse af zinknitrat.
Neutralisering
Tyv3(s) + 2HCl (aq) → CaClto(ac) + HtoO (l) + COto(g)
Saltsyre neutraliserer calciumcarbonatsaltet til dannelse af salt, calciumchlorid, vand og kuldioxid. COto det bobler og detekteres i vandet. Denne bobling opnås også ved at tilsætte HCI til kridt eller æggeskaller, der er rige på CaCO3.
NH3(g) + HCI (g) → NH4Cl (s)
I denne anden reaktion neutraliserer HCI-dampene den gasformige ammoniak. Ammoniumchloridsaltet, NH4Cl, er dannet som en hvidlig røg (lavere billede), da den indeholder meget fine partikler suspenderet i luften.

Dobbeltrulle
AgNO3(aq) + NaCl (aq) → AgCl (s) + NaNO3(ac)
I en dobbelt forskydningsreaktion er der en udveksling af "partnere". Sølv skifter partner med natrium. Resultatet er, at det nye salt, sølvchlorid, AgCl, udfældes som et mælkeagtigt fast stof..
Redox

Der er utallige redoxreaktioner. En af de mest imponerende er Barkin Dogs:
8 NtoO (g) + 4 CSto(l) → S8(s) + 4 COto(g) + 8 Nto(g)
Den energi, der frigøres, når de tre stabile produkter dannes, er så meget, at der er en blålig flash (øverste billede) og en rungende stigning i tryk forårsaget af de gasser, der stammer fra (COto og Nto).
Og derudover ledsages alt dette af en meget høj lyd, der ligner en hunds gøen. Det producerede svovl, S8, belægger rørets indre vægge i gul.
Hvilken art er reduceret, og hvilken er oxideret? Som hovedregel har elementerne oxidationstal 0. Derfor skal svovl og nitrogen i produkterne være de arter, der har fået eller mistet elektroner..
Svovloxideret (mistede elektroner), da det havde oxidationsnummer -2 i CSto (C4+Stoto-):
Sto- → S0 + 2e-
Mens nitrogen blev reduceret (optjente elektroner), fordi det havde oxidationstal +1 i NtoPÅto+ELLERto-):
2N+ + 2e → N0
Løst kemiske reaktioner øvelser
- Øvelse 1
Hvilket salt udfældes i den følgende reaktion i vandigt medium?
NatoS (ac) + FeSO4(ac) → ¿?
Som hovedregel udfældes alle sulfider, med undtagelse af dem, der er dannet med alkalimetaller og ammonium, i vandigt medium. En dobbelt forskydning opstår: jern binder til svovl og natrium til sulfat:
NatoS (ac) + FeSO4(ac) → FeS (s) + NatoSW4(ac)
- Øvelse 2
Hvilke produkter får vi fra følgende reaktion?
Frimærke3)to + Ca (OH)to →?
Calciumhydroxid er ikke særlig opløseligt i vand; men tilsætningen af kobbernitrat hjælper med at opløse det, fordi det reagerer og danner dets tilsvarende hydroxid:
Frimærke3)to(ac) + Ca (OH)to(ac) → Cu (OH)to(s) + Ca (NO3)to(ac)
Cu (OH)to straks genkendelig som et blåt bundfald.
- Øvelse 3
Hvilket salt produceres i den følgende neutraliseringsreaktion?
Al (OH)3(s) + 3HCl (aq) → ¿?
Aluminiumhydroxid opfører sig som en base, der reagerer med saltsyre. I en syre-base neutraliseringsreaktion (Bronsted-Lowry) dannes der altid vand, så det andet produkt skal være aluminiumchlorid, AlCl3:
Al (OH)3(s) + 3HCl (aq) → AlCl3(aq) + 3HtoELLER
Denne gang har AlCl3 udfældes ikke, fordi det er et salt (til en vis grad) opløseligt i vand.
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Ana Zita. (18. november 2019). Kemiske reaktioner. Gendannet fra: todamateria.com
- Kashyap Vyas. (23. januar 2018). 19 Seje kemiske reaktioner, der viser, at videnskab er fascinerende. Gendannet fra: interestingengineering.com
- BeautifulChemistry.net (s.f.). Reaktion. Gendannet fra: beautifulchemistry.net
- Wikipedia. (2019). Kemisk reaktion. Gendannet fra: en.wikipedia.org



Endnu ingen kommentarer