
Reduktion (kemi) hvad den består af og eksempler

Det reduktion Det er al den kemiske reaktion, hvor atomerne i en af reaktanterne ender med at få elektroner; Hvad kan også ses på denne måde: din ledige stilling eller elektroniske "ubehag" reduceres. Et atom får elektroner, når en art donerer dem; det er, det ruster.
Denne type reaktion kan ikke ske af sig selv: hvis en art accepterer elektronerne, skal en anden nødvendigvis opgive dem. Ellers ville der blive skabt stof fra ingenting, hvilket reducerer atomerne efter at have fået elektroner fra vakuumet. Derfor er det en redox halvreaktion (reduktion / oxidation).
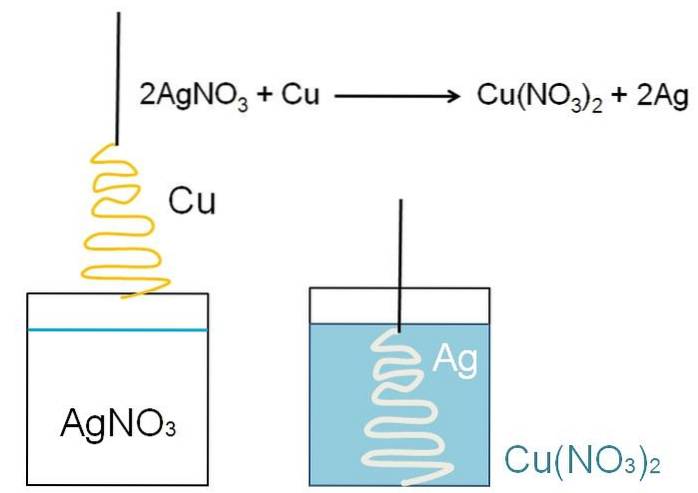
Et illustrativt eksempel på den reduktion, der kan vises i klasselokaler, er reaktionen mellem en metaloverflade af kobber og en vandig opløsning af sølvnitrat, AgNO3.
I opløsning findes sølv som kationer Ag+, positivt ladet. Disse, ved at interagere med overfladen af kobberet, formet som et juletræ, snapper elektronerne fra kobberatomerne. Når dette sker, erstatter kobber sølv i nitratsaltet; og som et resultat kobbernitrat, Cu (NO3)to.
Cu kationerto+ ved siden af NEJ3- drej opløsningen blålig; og sølv, hvidt juletræet som om det dækkede det med sne.
Artikelindeks
- 1 Hvad er reduktionen?
- 1.1 Antal ilt
- 1.2 Elektronegativt atom
- 2 Eksempler
- 2.1 Reduktion i organisk kemi
- 2.2 Metaludvinding
- 3 Referencer
Hvad er reduktionen?
Som reduktion er det allerede blevet sagt, at en art vinder elektroner. Hvordan kan dette verificeres i en kemisk ligning? For eksempel i ligningen for reaktionen mellem Cu og AgNO3, Hvordan ved jeg, hvornår reduktionen finder sted? For at bekræfte det er det nødvendigt at bestemme antallet eller oxidationstilstanden.
Elementerne i deres naturlige tilstande har pr. Definition en oxidationstilstand lig med nul, da det antages, at de hverken har mistet eller fået elektroner. Således har faste metaller nul oxidationstilstand. Således går sølvet fra +1 (Ag+) til 0 (Ag). Opladningen af en metalion er lig med dets oxidationstilstand.
På den anden side kom elektronerne fra kobber: går fra 0 (Cu) til +2 (Cuto+). Nitratanion, NEJ3- forbliver uændret, mens begge metaller udveksler elektroner; derfor kan ligningen skrives som:
2Ag+ + Cu => 2Ag + Cuto+
Bemærk, at både ladninger og atomer er afbalancerede..
Dette er hvad kemisk reduktion består af: i gevinsten af elektroner, der gør atomernes oxidationstilstande mindre positive end elektronernes..
Oxygennummer
Oxygener er meget elektronegative og oxiderende atomer, så når et atom danner forbindelser med dem (som oxider), har de positive oxidationstilstande. Jo større antal oxygener, der interagerer med atomet, jo mere positivt vil dets oxidationstilstand være; eller hvad er det samme, det er mere rustent.
Derfor, når en forbindelse har færre iltatomer, siges den at være mindre oxideret; atomenet mister færre elektroner.
Et klassisk eksempel kan ses i kulilte og kuldioxid. For CO har kulstof en oxidationstilstand på +2; mens for COto, dens oxidationstilstand er +4.
Så hvis CO i en reaktionto den omdannes til CO, en reduktion siges at forekomme; siden kulstof nu interagerer med et ilt og ikke to. For den modsatte reaktion omdannes CO til COto, der er tale om en oxidation af kulstof.
Dette gælder for alle atomer, især metaller i deres metaloxider; for eksempel CrOto (Cr4+) og CrO3 (Cr6+).
I kemiske ligninger hvor en art mister ilt, mens den anden art vinder det, siges der at der sker en iltoverførsel.
Elektronegativt atom
Du kan altid afgøre, om der var en reduktion ved at ændre oxidationstilstanden til en mindre positiv værdi. Som netop forklaret, er en hurtig måde at bemærke uden selv at gøre matematikken ved at observere, om der er et fald i iltatomer i en forbindelse..
Det samme kan ske med ethvert andet atom, der er mere elektronegativt end det atom, der vinder eller mister elektroner.
For eksempel hvis CF4 reagerer på en sådan måde, at det bliver CH4, en reduktion siges derefter at have fundet sted; da fluor er meget mere elektronegativ end hydrogenatomet. Som et resultat oxideres kulstof mindre i CH4 at i CF4, hvilket svarer til at sige, at det er blevet reduceret.
Eksempler
Reduktion i organisk kemi
CF-eksemplet4 og CH4 det afspejler, hvad der sker i organiske reaktioner, hvor reduktionen af et atoms delvise ladning betragtes som en elektronisk forstærkning. Dette gælder meget, når man overvejer reduktion af iltede funktionelle grupper..
Overvej f.eks. Grupperne ROH, RCHO og COOH. Den første svarer til alkoholer, hvor kulstofbinder med ilt (C-OH); det andet er aldehydgruppen, hvor carbon danner en dobbeltbinding med ilt og også er bundet til hydrogen (C = O-H); og den tredje er carboxylgruppen.
I carboxylgruppen danner kulstof en dobbeltbinding med en O og en enkeltbinding med en anden O (HO-C = O).
Derfor sker der en reduktion, hvis en carboxylsyre omdannes til en alkohol:
RCOOH => ROH
Metaludvinding
Kemisk reduktion er yderst vigtig i processerne til udvinding af metaller fra deres mineraler. Nogle af reaktionerne er:
HgS + Oto => Hg + SOto
Kviksølvsulfid reduceres til metallisk kviksølv.
CutoS + Oto => 2Cu + SOto
Kobbersulfid reduceres til metallisk kobber.
2ZnS + 3Oto => 2ZnO + 2SOto
ZnO + C => Zn + CO (bemærk overførsel af O)
Zinksulfid reduceres først til dets monoxid og derefter til dets metalliske form.
TrotoELLER3 + 3CO => 2Fe + 3COto
Jernoxid reduceres til metallisk jern.
WO3 + 3Hto => W + 3HtoELLER
Og wolframtrioxid reduceres til metallisk wolfram.
Som en øvelse kan oxidationsnummeret på metallet bestemmes, før det reduceres.
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Kemi LibreTexts. (9. december 2018). Oxidationsreduktionsreaktioner. Gendannet fra: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (4. juli 2018). Definitionen af reduktion i kemi. Gendannet fra: thoughtco.com
- Hultzman R. (2019). Reduktion i kemi: definition og oversigt. Undersøgelse. Gendannet fra: study.com
- Clark J. (2013). Definitioner af oxidation og reduktion (redox). Gendannet fra: chemguide.co.uk
- Tutor View. (s.f.). Reduktionsreaktion. Gendannet fra: chemistry.tutorvista.com


Endnu ingen kommentarer