
Binær salte Generel formel, nomenklatur og eksempler
Det binære salte er ioniske arter, der er almindeligt kendt inden for kemi, identificeret som stoffer, der er en del af stærke elektrolytter på grund af deres fuldstændige dissociation i deres bestanddele, når de er i en opløsning.
Udtrykket "binær" henviser til deres dannelse, da de kun er sammensat af to elementer: en kation af metallisk oprindelse med en simpel anion af ikke-metallisk oprindelse (bortset fra ilt), som er forbundet med en ionbinding..
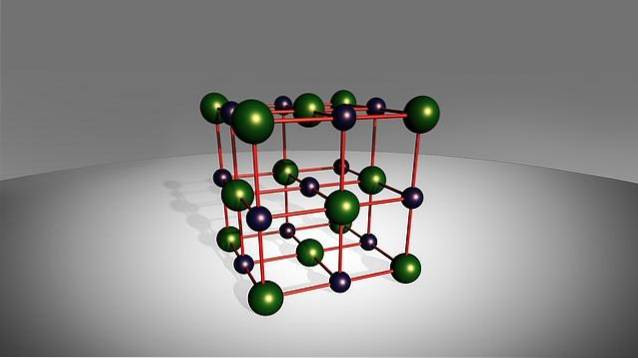
Selvom deres navn indikerer, at de kun er dannet af to elementer, forhindrer dette ikke, at der i nogle af disse salte kan være mere end et atom af metallet, det ikke-metal eller begge arter. På den anden side viser nogle af disse arter ret giftig opførsel, såsom natriumfluorid, NaF.
De kan også udvise høj reaktivitet, når de er i kontakt med vand, selvom disse egenskaber kan variere enormt mellem kemisk meget lignende salte..
Artikelindeks
- 1 Generel formel for binære salte
- 2 Nomenklatur for binære salte
- 2.1 Systematisk nomenklatur
- 2.2 Bestandsnomenklatur
- 2.3 Traditionel nomenklatur
- 3 Hvordan dannes binære salte?
- 4 Eksempler på binære salte
- 5 Referencer
Generel formel for binære salte
Som tidligere nævnt består binære salte af et metal og en ikke-metal i deres struktur, så deres generelle formel er Mmxn (hvor M er det metalliske element og X det ikke-metalliske element).
På denne måde kan de metaller, der er en del af de binære salte, være fra "s" -blokken i det periodiske system - alkalisk (såsom natrium) og jordalkali (såsom calcium) - eller fra "p" -blokken i periodisk system (som aluminium).
På samme måde er blandt de ikke-metalliske grundstoffer, der udgør denne type kemiske stoffer, dem fra gruppe 17 i det periodiske system, kendt som halogener (såsom klor), såvel som andre elementer i "p" -blokken såsom svovl eller nitrogen, undtagen ilt.
Nomenklatur for binære salte
Ifølge International Union of Pure and Applied Chemistry (IUPAC) kan tre systemer bruges til at navngive binære salte: systematisk nomenklatur, stamnomenklatur og traditionel nomenklatur.
Systematisk nomenklatur
Når du bruger denne metode, skal du begynde med navnet på det ikke-metal og tilføje slutningen -uro; for eksempel i tilfælde af et bromsalt (Br) ville det blive navngivet som "bromid".
Umiddelbart efter navngivning af det ikke-metal placeres præpositionen "af"; i det foregående tilfælde ville det være "bromid af".
Endelig navngives det metalliske element, som det normalt kaldes. Derfor, hvis det samme eksempel følges, og det er sammensat af kalium som metallet, ville forbindelsen blive skrevet som KBr (hvis struktur er afbalanceret korrekt) og kaldes kaliumbromid..
Hvis saltets støkiometri adskiller sig fra 1: 1-kombinationen, navngives hvert element ved hjælp af et præfiks, der angiver abonnementet eller antallet af gange, hver enkelt er fundet.
For eksempel kombinationsforholdet i CaCl-saltetto det er 1: 2 (for hvert calciumatom er der to klor), så det kaldes calciumdichlorid; forekommer på samme måde som de andre forbindelser.
Aktienomenklatur
Når du bruger denne procedure, starter du med at navngive forbindelsen på en meget lignende måde til, hvordan den gøres i den systematiske nomenklatur, men uden forud for nogen komponent i stoffet..
I dette tilfælde tages kun oxidationsnummeret af det metalliske element i betragtning (dets absolutte værdi i alle tilfælde).
For at navngive det binære salt skal du placere valensnummeret i den romerske notation i parentes efter artsnavnet. FeCl kan gives som et eksempelto som ifølge disse regler kaldes jern (II) chlorid.
Traditionel nomenklatur
Når normerne i den traditionelle nomenklatur følges, i stedet for at tilføje noget præfiks til saltets anion eller kation eller eksplicit placere metalets valensnummer, anbringes der et suffiks afhængigt af metalets oxidationstilstand.
For at bruge denne metode navngives det ikke-metal på samme måde som i lagermetoden, og hvis der er et salt, hvis grundstoffer har mere end et oxidationsnummer, skal det navngives ved hjælp af et suffiks, der angiver det..
Hvis det metalliske element bruger sit laveste oxidationsnummer, tilføjes suffikset "bjørn"; På den anden side, hvis du bruger det højeste valensnummer, tilføjes suffikset "ico"..
Et eksempel på dette kan være forbindelsen FeCl3, som kaldes "jernchlorid", fordi jern bruger sin maksimale valens (3). I saltet FeClto, hvor jern bruger sin laveste valens (2), anvendes navnet jernchlorid. Det sker på en lignende måde med resten.
Hvordan dannes binære salte?
Som tidligere nævnt dannes disse stoffer af en for det meste neutral karakter gennem kombinationen ved hjælp af en ionbinding af et metalelement (som dem fra gruppe 1 i det periodiske system) og en ikke-metallisk art (som de af gruppe 17 i det periodiske system) undtagen ilt- eller hydrogenatomer.
På samme måde er det almindeligt at finde ud af, at der ved kemiske reaktioner, der involverer binære salte, frigøres varme, hvilket betyder, at det er en exoterm reaktion. Derudover er der forskellige risici afhængigt af det salt, det behandles med.
Eksempler på binære salte
Nedenfor er nogle binære salte sammen med deres forskellige navne, afhængigt af den anvendte nomenklatur:
NaCl
- Natriumchlorid (traditionel nomenklatur)
- Natriumchlorid (stamnomenklatur)
- Natriummonochlorid (systematisk nomenklatur)
BaClto
- Bariumchlorid (traditionel nomenklatur)
- Bariumchlorid (stamnomenklatur)
- Bariumdichlorid (systematisk nomenklatur)
CoS
- Kobalt sulfid (radionær nomenklatur)
- Kobolt (II) sulfid (stamnomenklatur)
- Koboltmonosulfid (systematisk nomenklatur)
CotoS3
- Kobolt sulfid (traditionel nomenklatur)
- Kobolt (III) sulfid (stamnomenklatur)
- Dicobalt trisulfid (systematisk nomenklatur)
Referencer
- Wikipedia. (s.f.). Binær fase. Gendannet fra en.wikipedia.org
- Chang, R. (2007). Chemistry, niende udgave (McGraw-Hill).
- Levy, J. M. (2002). Hazmat Chemistry Study Guide, anden udgave. Gendannet fra books.google.co.ve
- Burke, R. (2013). Hazardous Materials Chemistry for Emergency Responders, tredje udgave. Gendannet fra books.google.co.ve
- Franzosini, P. og Sanesi, M. (2013). Termodynamiske og transportegenskaber for organiske salte. Gendannet fra books.google.co.ve



Endnu ingen kommentarer