
Propylen kemisk struktur, egenskaber og anvendelser

Det propylen eller propen ved omgivelsestemperatur og atmosfærisk tryk er i gasform og er ligesom andre alkener farveløs. Det har en lugt, der ligner olie, men mindre intens. Det præsenterer et dipolmoment, da skønt det mangler en stærk polær binding, er dets molekyle asymmetrisk.
På samme måde er propylen en strukturel isomer af cyclopropan (de har den samme kemiske formel C3H6). Det forekommer i naturen som en konsekvens af vegetations- og gæringsprocesserne. Det produceres kunstigt under forarbejdningen af fossile brændstoffer som olie, naturgas og i mindre grad kulstof.

Tilsvarende er ethylen og propylen produkter af råolieraffinering i en proces med opdeling af store carbonhydridmolekyler for at generere små carbonhydrider med stor efterspørgsel..
Propylen kan også fås ved hjælp af forskellige metoder:
- Ved reversibel omsætning af ethylen og buten, hvor dobbeltbindingerne brydes og omformuleres for at give propylen.
- Gennem en proces med dehydrogenering (tab af brint) af propan.
- Som en del af et program til produktion af olefiner fra methanol (MTO) blev propylen produceret af methanol. Dette blev ført gennem zeolitkatalysatoren, som fremmer dens dehydrering og fører til dannelsen af ethylen og propylen..
3CH3OH (methanol) => CH3CH = CHto (propylen) + 3HtoO (vand)
Artikelindeks
- 1 Kemisk struktur
- 2 egenskaber
- 2.1 Molekylvægt
- 2.2 Kogepunkt
- 2.3 Smeltepunkt
- 2.4 Flammepunkt
- 2.5 Opløselighed
- 2.6 Opløselighed udtrykt som masse
- 2.7 Tæthed
- 2.8 Dampdensitet
- 2.9 Damptryk
- 2.10 Selvantænding
- 2.11 Viskositet
- 2.12 Forbrændingsvarme
- 2.13 Fordampningsvarme
- 2.14 Overfladespænding
- 2.15 Polymerisering
- 2.16 Frysepunkt
- 2.17 Lugttærskel
- 3 anvendelser
- 3.1 Polypropylen
- 3.2 Akrylnitril
- 3.3 Propylenoxid
- 3.4 Til syntese af alkoholer og andre anvendelser
- 4 Referencer
Kemisk struktur
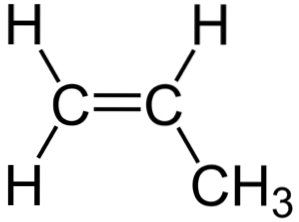
På det øverste billede kan du se den kemiske struktur af propylen, hvor dens asymmetri skiller sig ud (højre side er forskellig fra venstre). Dens kulstofskelet, eksklusive H-atomer, kan ses som en boomerang.
Denne boomerang har en umættethed eller dobbeltbinding på en af dens sider (C1) og er således flad på grund af sp-hybridiseringto af kulstofatomer.
Den anden side er imidlertid optaget af methylgruppen (-CH3), hvis hybridisering er sp3 og har en tetrahedral geometri. Så set forfra er boomerangen flad med H-atomer, der stikker ud fra den ved cirka 109,5 °.
I gasfasen interagerer molekylet svagt med andre ved dispersionskræfter. Ligeledes forhindres interaktionen mellem dobbeltbindingerne (π-π) af to propylenmolekyler af methylgruppen.
Dette resulterer i et fald i dets intermolekylære kræfter, hvilket afspejles i dets fysiske egenskaber. Kun ved meget lave temperaturer kan propylen vedtage en solid struktur, hvor boomerangen forbliver grupperet med deres svage interaktioner.
Ejendomme
Det er en farveløs gas med en aromatisk lugt. Det transporteres i form af flydende gas, og når det slipper ud af containerne, der indeholder det, gør det det i form af en gas eller væske. Ved lave koncentrationer danner den en eksplosiv og brandfarlig blanding med luft, idet densiteten af propylen er større end luftens..
Molekylær vægt
42,081 g / mol
Kogepunkt
53,9 ºF ved 760 mm Hg
48 ºC til 760 mmHg
Smeltepunkt
301,4 ºF
185 ºC
Flammepunkt
162ºF
Opløselighed
44,6 ml / 100 ml i vand.
1.250 ml / 100 ml i ethanol.
524,5 ml / 100 ml eddikesyre.
Opløselighed udtrykt som masse
200 mg / l 25 ºC
Massefylde
0,609 mg / ml ved -52,6 ° F
0,5139 ved 20 ° C
Dampmassefylde
1,46 ved 32ºF (i forhold til luft taget som reference).
1,49 (luft = 1).
1,91 kg / m3 ved 273,15 ºK
Damptryk
1 mmHg ved -205,4 ° F
760 mmHg ved -53,9 ° F
8,69 × 103 mmHg ved 25 ºC (ekstrapoleret værdi).
1.158 kPa ved 25 ºC
15,4 atm ved 37 ºC
Selvantændelse
851ºF
455 ºC
Viskositet
83,4 mikropoise ved 16,7 ºC.
Forbrændingsvarme
16.692 BTU / lb
10.940 cal / g
Fordampningsvarme
104,62 cal / g (ved kogepunkt)
Overfladespænding
16,7 dyn / cm ved 90 ° C
Polymerisering
Polymeriserer ved høje temperaturer og høje tryk i nærværelse af katalysatorer.
Frysepunkt
185,25 ° C.
Lugtgrænse
10-50 mg / m3 (opdagelse)
100 mg / m3 (anerkendelse)
Ansøgninger
Det bruges i den petrokemiske industri som et brændstof og alkyleringsmiddel. I den kemiske industri anvendes det som råmateriale til produktion og syntese af adskillige derivater.
Det er hovedsageligt nyttigt til fremstilling af polypropylen, acrylonitril (ACN), propylenoxid (PO), alkoholer, cumen og acrylsyre.
Polypropylen
Polypropylen er et af de vigtigste plastmaterialer, der anvendes i elektronik og elektrisk tilbehør, husholdningsartikler, flaskehætter og kufferter..
Det laminerede materiale bruges til emballering af slik, etiketter, cd'er osv., Mens fibrene bruges til at fremstille mapper og tøj..
Akrylnitril
Elastomere polymerer og fibre opnås fra acrylonitril. Disse fibre bruges til fremstilling af forskellige former for beklædning, såsom trøjer, sokker og sportstøj. De bruges også til boligindretning, mapper, polstring, hynder og tæpper..
Propylens OXID
Propylenoxid deltager som en komponent i syntesen af polyurethan. Dette anvendes til fremstilling af fleksibelt skum og stift skum. Fleksibelt skum bruges som fyldstof i hjemmemøbler og i bilindustrien.
På den anden side anvendes stift skum hovedsageligt som et bygningsisoleringsmateriale..
Propylenoxid anvendes også til fremstilling af propylenglycol. Denne forbindelse anvendes til fremstilling af umættede polyesterharpikser og som frostvæske..
Derudover anvendes propylenoxid til fremstilling af propylenglycolether. Denne ether kan anvendes til fremstilling af maling, tøj, blæk, harpiks og rengøringsmidler.
Til alkoholsyntese og andre anvendelser
Propylen tillader opnåelse af nogle alkoholer, blandt dem isopropanol, der bruges som opløsningsmiddel i kosmetik og produkter til personlig pleje. Derudover opfylder den funktionen som et antiseptisk middel.
- Isopropanol er involveret i fremstillingen af maling, harpiks, blæk og klæbebånd. Det bruges også i medicinalindustrien.
- Oxo-alkohol2-ethylhexanol anvendes til fremstilling af phthalat, blødgørere, klæbematerialer og maling.
- Butanol anvendes til fremstilling af maling, belægning, harpiks, farvestoffer, lægemidler og polymerer.
På den anden side produceres cumen fra kombinationen af propylen og benzen. Cumen er den vigtigste forbindelse til fremstilling af phenol og acetone, der anvendes i en række forskellige produkter, såsom polycarbonater, phenolharpikser, epoxyharpikser og methylmethacrylat..
Endelig anvendes acrylsyre - et andet produkt afledt af propylen - til fremstilling af acrylestere og harpikser til maling, belægning og klæbemiddelapplikationer..
Referencer
- Michal Osmenda. (26. december 2007). Tænd min ild. [Figur]. Hentet den 23. maj 2018 fra: commons.wikimedia.org
- Linde-gruppen. (2018). Propylen. Hentet 23. maj 2018 fra: linde-gas.com
- Wikipedia. (2018). Propen. Hentet den 23. maj 2018 fra: en.wikipedia.org
- PubChem. (2018). Propylen. Hentet den 27. maj 2018 fra: pubchem.ncbi.nlm.nih.gov
- Vesovic Velisa. (7. februar 2011). Propylen. Hentet den 27. maj 2018 fra: thermopedia.com
- Jeffrey S. Plotkin. (2016, 8. august). Propylenkvandalet. Hentet den 27. maj 2018 fra: acs.org
- ICIS. (6. november 2017). Propylenanvendelser og markedsdata. Hentet den 27. maj 2018 fra: icis.com



Endnu ingen kommentarer