
Forsæbningsreaktion og opnåelige stoffer

Det forsæbning er den basiske hydrolyse af en ester. Dette betyder, at esteren reagerer med en base (NaOH eller KOH) irreversibelt og producerer alkohol og natrium- eller kaliumcarboxylater. Ordet betyder "sæbefremstilling", og faktisk er det en af de ældste kemiske reaktioner, der anvendes af menneskeheden..
I babylonske tid perfektionerede de ved hjælp af aske indsamlet fra træ og planter og animalsk fedt kunsten at fremstille sæbe. Hvorfor animalsk fedt? Årsagen er, at den er rig på glycerol-triestere (triglycerider), og træaske er en kilde til kalium, det grundlæggende metal.
Ellers fortsætter reaktionen med et lavere udbytte, men nok til at afspejle dens virkning på maling og nogle overflader. Sådan er tilfældet med olielakker, hvor pigmenterne blandes med olie (esterkilde).
Artikelindeks
- 1 Forsæbningsreaktion
- 1.1 Mekanisme
- 1.2 Kinetik
- 2 Stoffer, der kan opnås ved forsæbning
- 2.1 Solvent handling af sæber
- 3 Referencer
Forsæbningsreaktion
Mekanisme
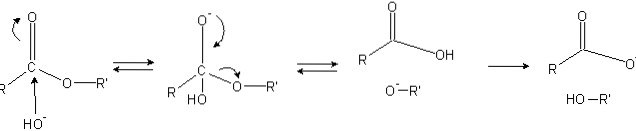
Estere har en acylgruppe (O = C-R), som er modtagelig for nukleofile angreb såsom OH-.
Fordi iltatomerne "stjæler" elektrondensiteten fra carbonatomet, er det delvist positivt ladet, endnu mere i tilfælde af estere.
Derfor tiltrækker denne positive ladning negative arter, der er i stand til at bidrage elektroner til kulstofatomet, hvilket forårsager nukleofilt angreb (venstre side af billedet). Som et resultat dannes et tetraedrisk mellemprodukt (det andet molekyle fra venstre til højre).
Den negative ladning på iltet i det tetraedriske mellemprodukt er produktet af en OH- omkringliggende. Denne negative ladning delokaliseres derefter for at give anledning til carbonylgruppen og "tvinger" derefter C-OR'-bindingen til at bryde. Ligeledes producerer denne delokalisering en carboxylsyre RCOOH og en alkoxidion R'O-.
Endelig, da reaktionsmediet er basisk, deprotonerer alkoxidet et vandmolekyle, og carboxylsyren reagerer med en anden OH.- mediet, der genererer forsæbningsprodukterne.
Kinetik
Forsæbningsreaktionens hastighed er proportional med koncentrationerne af reagenserne. Med andre ord, hvis enten koncentrationen af esteren (RCOOR ') eller basen (NaOH) øges, vil reaktionen forløbe hurtigere.
Dette oversættes også som følger: forsæbningshastigheden er første orden i forhold til esteren og første orden i forhold til basen. Ovenstående kan udtrykkes med følgende matematiske ligning:
Hastighed = k [RCOOR '] [NaOH]
Hvor k er den konstante eller hastighedskoefficient, der varierer som en funktion af temperatur eller tryk; jo højere varmen er, jo højere er forsæbningshastigheden. Af denne grund koges mediet.
Da begge reaktanter er af den første kinetiske orden, er den samlede reaktion af anden orden.
I forsæbningsreaktionsmekanismen kræver dannelsen af det tetraedriske mellemprodukt nukleofilt angreb, som involverer både esteren og basen..
Andenordens kinetik afspejles således i denne kendsgerning, fordi de griber ind i det afgørende (langsomme) trin i reaktionen.
Stoffer, der kan opnås ved forsæbning

De vigtigste produkter til forsæbning er alkoholer og salte af carboxylsyrer. I et surt medium opnås den respektive RCOOH opnået ved forsæbning af fedtstoffer og olier, der er kendt som fedtsyrer.
Således består sæber af salte af fedtsyrerne produceret ved forsæbning. Kommer du ud med hvilke kationer? De kan være Na+, K+, Mgto+, Tro3+, etc.
Disse salte er opløselige i vand, men udfældes ved hjælp af NaCl tilsat til blandingen, som dehydrerer sæben og adskiller den fra den vandige fase. Forsæbningsreaktionen for et triglycerid er som følger:
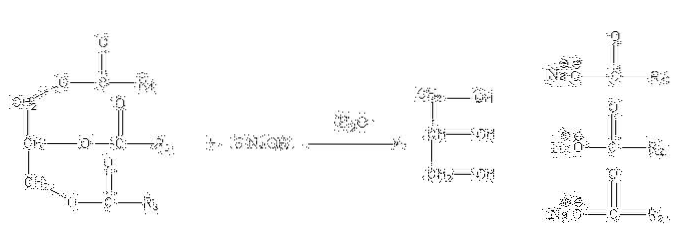
Glycerin er det alkoholiske "E", og sæbe er alle salte af de resulterende fedtsyrer. Her har hver -R-sidekæde forskellige længder og grad af umætning. Derfor gør disse kæder forskellen mellem vegetabilske fedtstoffer og olier.
Nøglen til fremstilling af sæber ligger derefter i udvælgelsen af de bedste fedtstoffer og olier eller mere specifikt i udvælgelsen af forskellige kilder til triglycerider..
Denne sæbevidte hvide masse kan indeholde farvestoffer og andre organiske forbindelser i sin struktur, hvilket giver den behagelige aromaer og lyse farver. Herfra tæmmes række muligheder af kunst og kald i denne handel..
Forsæbningsreaktionen er imidlertid også en syntetisk vej for carboxylsyrer og alkoholer, der ikke nødvendigvis har at gøre med glycerin eller sæber..
For eksempel vil basisk hydrolyse af en hvilken som helst ester, såsom simpelt ethylacetat, producere eddikesyre og ethanol..
Solvent handling af sæber

Fedtsyresalte er opløselige i vand, men ikke på samme måde som ioner er solvatiseret; det vil sige omgivet af en vandig kugle. I tilfælde af sæber forhindrer deres -R-sidekæder teoretisk dem i at opløses i vand.
For at modvirke denne energisk akavede position er de orienteret på en sådan måde, at disse kæder kommer i kontakt og danner en apolar organisk kerne, mens de polære hoveder, den ekstreme (-COO- Na+), interagere med vandmolekyler og skabe en "polar skal".
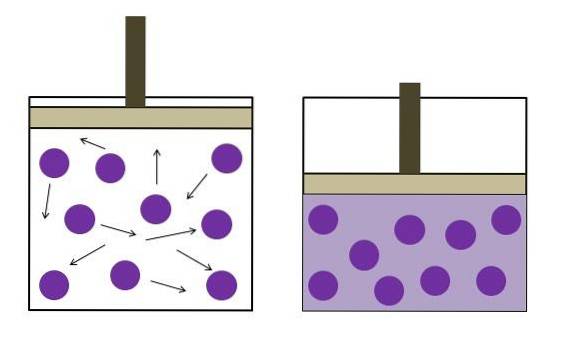
Ovenstående er illustreret i det øverste billede, hvor denne type struktur kendt som en micelle er vist.
De "sorte haler" svarer til de hydrofobe kæder, der vikler sig ind i en organisk kerne beskyttet af de grå kugler. Disse grå kugler udgør den polære kuarasse, -COO hovederne- Na+.
Så miceller er klynger (byområder) af fedtsyresalte. Inden for disse kan de indeholde fedt, som er uopløseligt i vand på grund af dets ikke-polære karakter..
Hvordan gør de det? Både fedt- og -R-kæder er hydrofobe, så begge har en høj affinitet for hinanden.
Når micellerne omslutter fedtstoffer, interagerer vandet med den polære skal, hvilket muliggør opløseligheden af sæben. Ligeledes er micellerne negativt ladede, hvilket forårsager afstødninger på hinanden og derfor genererer spredning af fedt..
Referencer
- Anne Marie Helmenstine, Ph.D. (3. oktober 2017). Forsæbning Definition og reaktion. Hentet den 24. april 2018 fra: thoughtco.com
- Francis A. Carey. Organisk kemi. Carboxylsyrer. (sjette udgave, side 863-866). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organisk kemi. Lipider (10. udgave., Sider 1056-1058). Wiley plus.
- Wikipedia. (2018). Forsæbning. Hentet den 24. april 2018 fra: en.wikipedia.org
- Boyd C. (27. februar 2015). Forstå sæbets kemi og historie. Hentet den 24. april 2018 fra: chemservice.com
- Luca Laghi. (27. marts 2007). Forsæbning. Hentet den 24. april 2018 fra: commons.wikimedia.org
- Amanda Hæklet. (12. maj 2015). Micelle (gråtoner). Hentet den 24. april 2018 fra: commons.wikimedia.org


Endnu ingen kommentarer