
Zinksulfid (ZnS) struktur, egenskaber og anvendelser
Det zinksulfid er en uorganisk forbindelse med formlen ZnS, dannet af Zn-kationerto+ og S anionerto-. Det findes i naturen hovedsageligt som to mineraler: wurtzite og sphalerite (eller zink blende), sidstnævnte er dens vigtigste form.
Sphalerite er sort af natur på grund af urenhederne. I sin rene form har den hvide krystaller, mens wurtzit har gråhvide krystaller..

Zinksulfid er uopløselig i vand. Det kan forårsage miljøskader, da det trænger ind i jorden og forurener grundvand og dets strømme.
Zinksulfid kan produceres, blandt andre reaktioner, ved korrosion og ved neutralisering.
Ved korrosion:
Zn + HtoS => ZnS + Hto
Ved neutralisering:
HtoS + Zn (OH)to => ZnS + 2HtoELLER
Zinksulfid er et fosforescerende salt, der giver det kapacitet til flere anvendelser og applikationer. Derudover er det en halvleder og en fotokatalysator.
Artikelindeks
- 1 Struktur
- 1.1 Zink blende
- 1.2 Wurzita
- 2 egenskaber
- 2.1 Farve
- 2.2 Smeltepunkt
- 2.3 Opløselighed i vand
- 2.4 Opløselighed
- 2,5 Massefylde
- 2.6 Hårdhed
- 2.7 Stabilitet
- 2.8 Nedbrydning
- 3 Nomenklatur
- 3.1 Systematiske og traditionelle nomenklaturer
- 4 anvendelser
- 4.1 Som pigmenter eller overtræk
- 4.2 På grund af dets phosphorescens
- 4.3 Halvleder, fotokatalysator og katalysator
- 5 Referencer
Struktur
Zinksulfid vedtager krystallinske strukturer styret af elektrostatiske attraktioner mellem Zn-kationento+ og anionen Sto-. Disse er to: sphalerit eller zink blende og wurzite. I begge minimerer ionerne frastødningerne mellem ioner med lige store ladninger..
Zink blende er den mest stabile under de jordiske forhold med tryk og temperatur; og wurzit, som er mindre tæt, skyldes krystallinsk omlejring på grund af øget temperatur.
De to strukturer kan eksistere sammen i det samme ZnS-faste stof på samme tid, selvom wurzitten meget langsomt ender med at dominere..
Zink blende

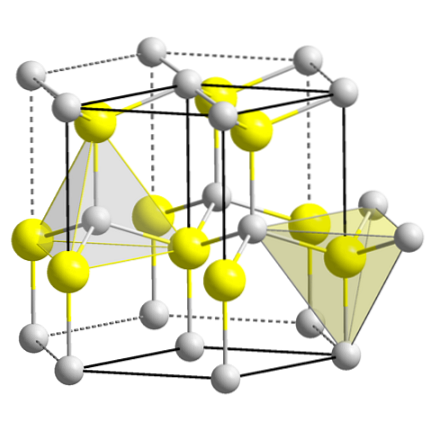
Det øverste billede viser den kubiske enhedscelle centreret på overfladerne af zinkblendestrukturen. De gule kugler svarer til anionerne Sto-, og de grå til Zn-kationerneto+, placeret i hjørnerne og i midten af terningen.
Bemærk de tetraedriske geometrier omkring ionerne. Zink blende kan også repræsenteres af disse tetraedre, hvis huller inde i krystallen har samme geometri (tetraedriske huller).
Ligeledes inden for enhedscellerne er ZnS-forholdet opfyldt; et forhold på 1: 1. Således for hver Zn-kationto+ der er en anion Sto-. På billedet kan det virke som om der er masser af grå sfærer, men i virkeligheden deles de af andre celler, da de er i hjørnerne og midten af terningens ansigter..
Hvis du f.eks. Tager de fire gule kugler, der er inde i kassen, skal "stykkerne" af alle de grå kugler omkring den være lig med (og de gør) fire. Således er der i den kubiske enhedscelle fire Znto+ og fire Sto-, opfylder det støkiometriske forhold ZnS.
Det er også vigtigt at understrege, at der er tetraedriske huller foran og bag de gule kugler (det rum, der adskiller dem fra hinanden).
Wurzita
I modsætning til strukturen af zink blende vedtager wurzit et sekskantet krystalsystem (topbillede). Dette er mindre kompakt, så det faste stof har en lavere tæthed. Ionerne i wurzit har også tetraedriske omgivelser og et forhold på 1: 1, der stemmer overens med ZnS-formlen..
Ejendomme
Farve
Det kan præsenteres på tre måder:
-Wurtzite med hvide og sekskantede krystaller.
-Sphalerite med gråhvide krystaller og kubiske krystaller.
-Som et hvidt til gråhvidt eller gulligt pulver og kubiske gulagtige krystaller.
Smeltepunkt
1700 ºC.
Vandopløselighed
Praktisk talt uopløselig (0,00069 g / 100 ml ved 18 ° C).
Opløselighed
Uopløselig i baser, opløselig i fortyndede mineralsyrer.
Massefylde
Sphalerite 4,04 g / cm3 og wurtzite 4,09 g / cm3.
Hårdhed
Har en hårdhed på 3 til 4 på Mohs-skalaen.
Stabilitet
Når det indeholder vand, oxiderer det langsomt til sulfat. I et tørt miljø er det stabilt.
Nedbrydning
Når det opvarmes til høje temperaturer, udsender det giftige dampe af zink og svovloxider.
Nomenklatur
Elektronkonfigurationen af Zn er [Ar] 3d104sto. Ved at miste de to elektroner i 4s orbital forbliver det som Zn-kationento+ med deres d orbitaler fyldt. Derfor, da elektronisk Znto+ det er meget mere stabilt end Zn+, den har kun en valens på +2.
Derfor er det udeladt i stamnomenklaturen, idet valensen tilføjes i parentes og med romertal: zinksulfid (II).
Systematiske og traditionelle nomenklaturer
Men der er andre måder at ringe til ZnS ud over den allerede rejste. I systematik specificeres antallet af atomer for hvert element med de græske tællere; med den eneste undtagelse af elementet til højre, når det kun er et. Således navngives ZnS som: abezinksulfid (og ikke monozink monosulfid).
Med hensyn til den traditionelle nomenklatur tilføjes zink med en enkelt valens på +2 ved at tilføje suffikset -ico. Derfor resulterer dets traditionelle navn: zinksulfidico.
Ansøgninger
Som pigmenter eller belægninger
-Sachtolith er et hvidt pigment lavet med zinksulfid. Anvendes i tætninger, mastik, fugemasse, undercoating, latexmaling og skiltning.
Dens anvendelse i kombination med ultraviolet lysabsorberende pigmenter, såsom mikrotitanium eller gennemsigtige jernoxidpigmenter, er nødvendig i vejrbestandige pigmenter.
-Når ZnS påføres latex- eller strukturmaling, har det en langvarig mikrobicid virkning.
-På grund af sin store hårdhed og modstandsdygtighed over for brud, erosion, regn eller støv gør den den velegnet til udvendige infrarøde vinduer eller i flyrammer.
-ZnS bruges til belægning af rotorer, der anvendes til transport af forbindelser, for at reducere slid. Det bruges også til produktion af trykfarver, isolerende forbindelser, termoplastisk pigmentering, flammebestandig plast og elektroluminescerende lamper..
-Zinksulfid kan være gennemsigtigt og kan bruges som et vindue til synlig optik og infrarød optik. Anvendes i nattsyn, tv-skærme, radarskærme og fluorescerende belægninger.
-ZnS med Cu-doping anvendes til produktion af elektroluminescenspaneler. Det bruges også til raketfremdrivning og gravimetri.
For dets fosforescens
-Dens fosforescens bruges til at tonede urets hænder og dermed vise tiden i mørket; også i maling til legetøj, i nødskilte og trafikadvarsler.
Fosforescens tillader brugen af zinksulfid i katodestrålerør og røntgenskærme til at gløde i mørke pletter. Farven på phosphorescens afhænger af den anvendte aktivator.
Halvleder, fotokatalysator og katalysator
-Sphalerite og wurtzite er bredbåndsslids halvledere. Sphalerite har en båndspalte på 3,54 eV, mens wurtzite har en båndspalte på 3,91 eV.
-ZnS bruges til fremstilling af en fotokatalysator sammensat af CdS - ZnS / zirconium - titaniumphosphat anvendt til brintproduktion under synligt lys.
-Det fungerer som en katalysator for nedbrydningen af organiske forurenende stoffer. Bruges til forberedelse af en farvesynkronisering i LED-lamper.
-Dens nanokrystaller bruges til påvisning af ultrafølsomt protein. For eksempel ved at udsende lys fra kvanteprikker af ZnS. Det bruges til fremstilling af en kombineret fotokatalysator (CdS / ZnS) -TiO2 til elektrisk produktion via fotoelektrokatalyse.
Referencer
- PubChem. (2018). Zinksulfid. Hentet fra: pubchem.ncbi.nlm.nih.gov
- QuimiNet. (2015, 16. januar). Hvidt pigment baseret på zinksulfid. Gendannet fra: quiminet.com
- Wikipedia. (2018). Zinksulfid. Hentet fra: en.wikipedia.org
- II-VI UK. (2015). Zinksulfid (ZnS). Hentet fra: ii-vi.es
- Rob Toreki. (2015, 30. marts). Zincblende (ZnS) -strukturen. Hentet fra: ilpi.com
- Kemi LibreTexts. (22. januar 2017). Structure-Zink Blende (ZnS). Hentet fra: chem.libretexts.org
- Reade. (2018). Zinksulfid / Zinksulfid (ZnS). Hentet fra: reade.com
Endnu ingen kommentarer