
Overfladespænding årsager, eksempler, applikationer og eksperimenter
Det overfladespænding Det er en fysisk egenskab, som alle væsker er til stede og er kendetegnet ved den modstand, som deres overflader modsætter sig enhver stigning i deres område. Dette er det samme som at sige, at overfladen vil se efter det mindste mulige område. Dette fænomen fletter sammen flere kemiske begreber, såsom samhørighed, adhæsion og intermolekylære kræfter..
Overfladespænding er ansvarlig for dannelsen af overfladekurver af væsker i rørformede beholdere (graduerede cylindre, kolonner, reagensglas osv.). Disse kan være konkave (buede i form af en dal) eller konvekse (buede i en kuppelform). Mange fysiske fænomener kan forklares ved at overveje de ændringer, som en væskes overfladespænding gennemgår..

Et af disse fænomener er flydende molekylers tendens til at agglomerere i form af dråber, når de hviler på overflader, der afviser dem. For eksempel kan vanddråberne, som vi ser oven på bladene, ikke fugte det på grund af dets voksagtige, hydrofobe overflade..
Der kommer dog en tid, hvor tyngdekraften spiller sin rolle, og dråben spildes ud som en søjle med vand. Lignende fænomen forekommer i sfæriske dråber kviksølv, når det spildes fra et termometer.
På den anden side er overfladespændingen af vand den vigtigste af alt, da det bidrager til og organiserer tilstanden af mikroskopiske legemer i vandige medier, såsom celler og deres lipidmembraner. Derudover er denne spænding ansvarlig for, at vandet fordamper langsomt, og nogle kroppe er tættere, end det kan flyde på overfladen..
Artikelindeks
- 1 Årsager til overfladespænding
- 2 enheder
- 3 Overfladespænding af vand
- 4 Andre eksempler
- 4.1 Kondenserede gasser
- 4.2 Ikke-polære væsker
- 4.3 Polære væsker
- 5 applikationer
- 5.1 Vaskemidler
- 5.2 Emulsioner
- 6 enkle eksperimenter
- 6.1 Klipeksperiment
- 6.2 Papirbåd
- 7 Referencer
Årsager til overfladespænding
Forklaringen på fænomenet overfladespænding er på molekylært niveau. Væskens molekyler interagerer med hinanden på en sådan måde, at de er sammenhængende i deres uregelmæssige bevægelser. Et molekyle interagerer med sine naboer ved siden af det og med dem over eller under det.
Dette sker dog ikke det samme med molekylerne på overfladen af væsken, som er i kontakt med luft (eller anden gas) eller med et fast stof. Molekyler på overfladen kan ikke samhørighed med dem i det ydre miljø.
Som et resultat oplever de ingen kræfter, der trækker dem opad; kun nedad fra sine naboer i det flydende medium. For at modvirke denne ubalance "klemmer" overflademolekylerne, for kun på denne måde kan de overvinde den kraft, der skubber dem ned.
Derefter oprettes en overflade, hvor molekylerne er i et mere anspændt arrangement. Hvis en partikel ønsker at trænge igennem væsken, skal den først krydse denne molekylære barriere, der er proportional med overfladespændingen af væsken. Det samme gælder for en partikel, der ønsker at flygte til det ydre miljø fra væskens dybde..
Derfor opfører overfladen sig som om det var en elastisk film, der viser modstand mod deformation..
Enheder
Overfladespænding er normalt repræsenteret af symbolet γ og udtrykkes i enheder N / m, kraft gange længde. Men det meste af tiden er dens enhed dyn / cm. Den ene kan konverteres til den anden ved hjælp af følgende konverteringsfaktor:
1 dyn / cm = 0,001 N / m
Overfladespænding af vand
Vand er den sjældneste og mest fantastiske af alle væsker. Dens overfladespænding såvel som flere af dens egenskaber er usædvanligt høj: 72 dyn / cm ved stuetemperatur. Denne værdi kan stige til 75,64 dyn / cm ved en temperatur på 0 ºC; eller sænkes til 58,85 ºC ved en temperatur på 100 ºC.
Disse observationer giver mening, når man overvejer, at den molekylære barriere strammer sig endnu mere ved temperaturer tæt på frysning, eller den "løsner" lidt mere omkring kogepunktet..
Vand har en høj overfladespænding på grund af dets hydrogenbindinger. Hvis disse i sig selv er synlige i væsken, er de endnu mere på overfladen. Vandmolekyler er stærkt viklet sammen og danner H-type dipol-dipol-interaktioner.toOH OH.

Sådan er effektiviteten af deres interaktioner, at den vandige molekylære barriere endda kan understøtte nogle kroppe, før de synker. I afsnittene applikationer og eksperimenter genoptages dette punkt.
Andre eksempler
Alle væsker har overfladespændinger, enten i mindre eller større grad end vand, eller hvad enten de er rene stoffer eller opløsninger. Hvor stærk og anspændt de molekylære barrierer på dens overflader er, vil afhænge direkte af deres intermolekylære interaktioner såvel som strukturelle og energiske faktorer..
Kondenserede gasser
For eksempel interagerer molekyler af gasser i flydende tilstand kun med hinanden gennem London-spredningskræfter. Dette stemmer overens med det faktum, at deres overfladespændinger har lave værdier:
-Flydende helium, 0,37 dyn / cm ved -273 ºC
-Flydende nitrogen, 8,85 dyn / cm ved -196 ºC
-Flydende ilt, 13,2 dyn / cm ved -182 ºC
Overfladespændingen for flydende ilt er højere end for helium, fordi dens molekyler har en større masse..
Apolar væsker
Ikke-polære og organiske væsker forventes at have højere overfladespændinger end disse kondenserede gasser. Blandt nogle af dem har vi følgende:
-Diethylether, 17 dyn / cm ved 20 ° C
-n-Hexan, 18,40 dyn / cm ved 20 ° C
-n-Octan, 21,80 dyn / cm ved 20 ° C
-Toluen, 27,73 dyn / cm ved 25 ºC
En lignende tendens observeres for disse væsker: overfladespænding stiger, når deres molekylmasse stiger. Men den n-Octan skal ifølge denne have den højeste overfladespænding og ikke toluen. Her spiller molekylære strukturer og geometrier ind.
Toluenmolekyler, flade og ringede, har mere effektive interaktioner end dem af n-oktan. Derfor er toluenens overflade "strammere" end overfladen af n-oktan.
Polære væsker
Da der er stærkere dipol-dipol-interaktioner mellem molekylerne i en polær væske, er deres tendens til at vise højere overfladespændinger. Men dette er ikke altid tilfældet. Blandt nogle eksempler har vi:
-Eddikesyre, 27,60 dyn / cm ved 20 ° C
-Aceton, 23,70 dyn / cm ved 20 ° C
-Blod, 55,89 dyn / cm ved 22 ° C
-Ethanol, 22,27 dyn / cm ved 20 ° C
-Glycerol, 63 dyn / cm ved 20 ° C
-Smeltet natriumchlorid, 163 dyn / cm ved 650 ° C
-6 M NaCl-opløsning, 82,55 dyn / cm ved 20 ° C
Smeltet natriumchlorid forventes at have enorm overfladespænding: det er en tyktflydende, ionisk væske..
På den anden side er kviksølv en af væskerne med den højeste overfladespænding: 487 dyn / cm. I den er dens overflade sammensat af stærkt sammenhængende kviksølvatomer, meget mere end vandmolekyler kan være..
Ansøgninger

Overfladespænding alene har ingen anvendelser. Dette betyder dog ikke, at det ikke er involveret i forskellige daglige fænomener, som hvis de ikke eksisterede, ikke ville forekomme..
For eksempel er myg og andre insekter i stand til at gå gennem vand. Dette skyldes, at deres hydrofobe ben frastøder vand, mens deres lave masse giver dem mulighed for at holde sig flydende på den molekylære barriere uden at falde til bunden af floden, søen, dammen osv..
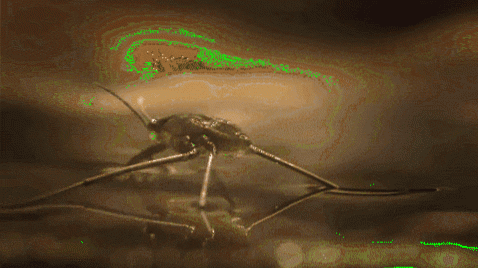
Overfladespænding spiller også en rolle i væskens befugtning. Jo højere overfladespænding, desto mindre er dens tendens til at sive gennem porer eller revner i et materiale. Derudover er de ikke særlig nyttige væsker til rengøring af overflader.
Vaskemidler
Det er her, hvor rengøringsmidler virker, hvilket reducerer vandets overfladespænding og hjælper det med at dække større overflader; samtidig med at dets affedtningseffekt forbedres. Ved at mindske overfladespændingen giver det plads til luftmolekyler, som det danner bobler med..
Emulsioner
På den anden side er lave højere spændinger knyttet til stabiliseringen af emulsionerne, som er meget vigtige i formuleringen af et andet produktprogram..
Enkle eksperimenter

Endelig citeres nogle eksperimenter, der kan udføres i ethvert hjemligt rum..
Klip eksperiment
Et metalklemme placeres på overfladen i et glas koldt vand. Som det ses på billedet ovenfor, vil klippet forblive flydende takket være vandets overfladespænding. Men hvis du tilføjer en lille smule lergodslava til glasset, vil overfladespændingen falde dramatisk, og papirclipsen vil pludselig synke..
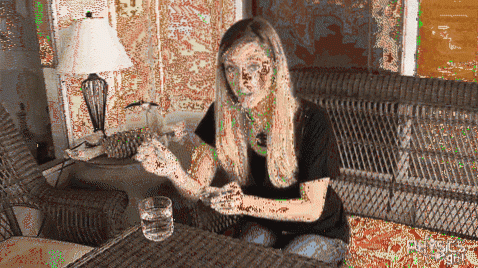
Papirbåd
Hvis vi på overfladen har en papirbåd eller en træpalle, og hvis opvaskemaskinen eller vaskemidlet føjes til hovedet på en vatpind, så vil der opstå et interessant fænomen: der vil være en frastødning, der vil sprede dem mod kanterne af glas. Papirbåden og træpallen bevæger sig væk fra den vaskemiddel-udtværede vatpind.

Et andet lignende og mere grafisk eksperiment består i at gentage den samme operation, men i en spand vand drysset med sort peber. De sorte peberpartikler vil glide væk, og overfladen vil skifte fra peber dækket til krystalklar med peber på kanterne.
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Wikipedia. (2020). Overfladespænding. Gendannet fra: en.wikipedia.org
- USGS. (s.f.). Overfladespænding og vand. Gendannet fra: usgs.gov
- Jones, Andrew Zimmerman. (12. februar 2020). Overfladespænding - Definition og eksperimenter. Gendannet fra: thoughtco.com
- Susanna Laurén. (2017, 15. november). Hvorfor er overfladespænding vigtig? Biolin Scientific. Gendannet fra: blog.biolinscientific.com
- Rookie Parenting Science. (7. november 2019). Hvad er overfladespænding | Cool videnskabseksperiment. Gendannet fra: rookieparenting.com
- Jessica Munk. (2020). Overfladespændingseksperimenter. Undersøgelse. Gendannet fra: study.com
- Barnet skal se dette. (2020). Syv eksperimenter med overfladespænding - Physics Girl. Gendannet fra: thekidshouldseethis.com



Endnu ingen kommentarer