
Ritchter-Wenzel lovhistorier, udsagn og eksempler

Det Ritchter-Wenzel lov eller af de gensidige proportioner er en, der fastslår, at masseforholdene mellem to forbindelser gør det muligt at bestemme den for en tredje forbindelse. Det er en af støkiometri-lovene sammen med Lavoisiers lov (lov om bevarelse af masse); Prousts lov (lov med bestemte proportioner); og Daltons lov (lov af flere proportioner).
Ritcher fortalte sin lov i 1792 i en bog, der definerede grundlæggende støkiometri, baseret på forskningsværkerne af Carl F Wenzel, der i 1777 offentliggjorde den første ækvivalenstabel for syrer og baser..
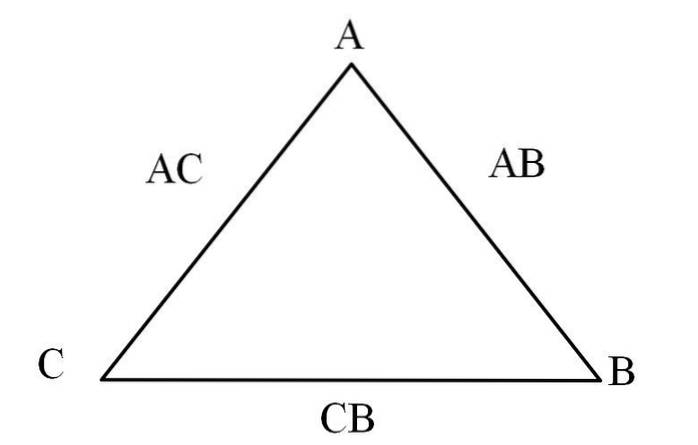
En enkel måde at visualisere det på er gennem en "gensidighedstrekant" (billedet ovenfor). Hvis du kender masserne af A, C og B, der blandes for at danne forbindelser AC og AB, kan du bestemme, hvor meget af C og B der blandes eller reagerer for at danne forbindelse CB.
I forbindelser AC og AB er element A til stede i begge, så ved at dele deres masseforhold vil finde ud af, hvor meget C reagerer med B.
Artikelindeks
- 1 Historie og almindelighed af loven af gensidige dimensioner
- 2 Erklæringer og konsekvenser
- 3 eksempler
- 3.1 Calciumchlorid
- 3.2 Svovloxider
- 3.3 Jernsulfid og oxid
- 4 Referencer
Lovenes historie og generelle gensidige proportioner
Richter fandt ud af, at vægtforholdet mellem de forbindelser, der indtages i en kemisk reaktion, altid er det samme.
I denne henseende fandt Ritcher, at der kræves 615 vægtdele magnesia (MgO), for eksempel for at neutralisere 1000 vægtdele svovlsyre.
Mellem 1792 og 1794 offentliggjorde Ritcher et resumé med tre bind indeholdende sit arbejde om loven med bestemte proportioner. Abstraktet beskæftigede sig med støkiometri og definerede det som kunsten til kemiske målinger..
Derudover bemærkes, at støkiometri beskæftiger sig med de love, ifølge hvilke stoffer forenes for at danne forbindelser. Richters forskningsarbejde blev imidlertid kritiseret for den matematiske behandling, han brugte, og det blev endda påpeget, at han justerede sine resultater.
I 1802 offentliggjorde Ernst Gottfried Fischer den første tabel over kemiske ækvivalenter, der anvendte svovlsyre med tallet 1000; svarende til værdien fundet af Richter til neutralisering af svovlsyre ved magnesia.
Imidlertid er det blevet bemærket, at Richter konstruerede en tabel med kombinationsvægte, der angav den hastighed, hvormed et antal forbindelser reagerede. For eksempel er det anført, at 859 dele NaOH neutraliserer 712 dele HNO3.
Erklæringer og konsekvenser
Erklæringen fra Richter-Wenzel-loven er følgende: masserne af to forskellige elementer, der kombineres med den samme mængde af et tredje element, holder det samme forhold som masserne af disse grundstoffer, når de kombineres med hinanden.
Denne lov tillod at etablere den ækvivalente vægt eller vægtækvivalent gram som mængden af et element eller en forbindelse, der vil reagere med en fast mængde af et referencestof.
Richter kaldte kombinationsvægte i forhold til vægten af elementerne, der kombinerede med hvert gram brint. De relative kombinationsvægte for Richter svarer til det, der i øjeblikket er kendt som den ækvivalente vægt af grundstoffer eller forbindelser.
I overensstemmelse med den tidligere fremgangsmåde kan Richter-Wenzel-loven anføres som følger:
Kombinationsvægtene for forskellige elementer, der kombineres med en given vægt af et givet element, er de relative kombinationsvægte for disse elementer, når de kombineres med hinanden, eller multipler eller submultipler af disse størrelsesforhold.
Eksempler
Kalcium Klorid
I calciumoxid (CaO) kombineres 40 g calcium med 16 g ilt (O). I mellemtiden i hypokloroxid (Clto71 g klor kombineres med 16 g ilt. Hvilken forbindelse ville calcium fremstille, hvis det blev kombineret med klor?
Ved hjælp af trekanten af gensidighed er ilt det fælles element for de to forbindelser. Masseforholdene for de to oxygenater bestemmes først:
40 g Ca / 16 gO = 5 g Ca / 2 g O
71 g Cl / 16 g O
Og nu deler vi de to masseproportioner af CaO og CltoEllers har vi:
(5 g Ca / 2 g O) / (71 g Cl / 16 g O) = 80 g Ca / 142 g Cl = 40 g Ca / 71 g Cl
Bemærk, at loven om masseforhold er opfyldt: 40 g calcium reagerer med 71 g klor.
Svovloxider
Oxygen og svovl reagerer med kobber for at give henholdsvis kobberoxid (CuO) og kobbersulfid (CuS). Hvor meget svovl ville reagere med ilt?
I kobberoxid kombineres 63,5 g kobber med 16 g ilt. I kobbersulfid binder 63,5 g kobber til 32 g svovl. Ved at opdele de masseproportioner, vi har:
(63,5 g Cu / 16 g O) / (63,5 g Cu / 32 g S) = 2032 g S / 1016 g O = 2 g S / 1 g O
Masseforholdet 2: 1 er et multiplum af 4 (63,5 / 16), hvilket viser, at Richters lov er sand. Med denne andel opnås SO, svovlmonoxid (32 g svovl reagerer med 16 g ilt).
Hvis du deler dette forhold med to, får du 1: 1. Igen er det nu et multiplum af 4 eller 2, og derfor handler det om SOto, svovldioxid (32 g svovl reagerer med 32 g ilt).
Jernsulfid og oxid
Jernsulfid (FeS), hvor 32 g svovl kombineres med 56 g jern, omsættes med jernoxid (FeO), hvor 16 g ilt kombineres med 56 g jern. Denne vare tjener som reference.
I de reagerende forbindelser FeS og FeO findes svovl (S) og ilt (O) i forhold til jern (Fe) i forholdet 2: 1. I svovloxid (SO) kombineres 32 g svovl med 16 g ilt, så svovl og ilt er i forholdet 2: 1.
Dette indikerer, at loven om gensidige proportioner eller Richters lov er opfyldt.
Forholdet mellem svovl og ilt i svovloxid (2: 1) kunne f.eks. Bruges til at beregne, hvor meget ilt der reagerer med 15 g svovl.
g ilt = (15 g S) ∙ (1 g O / 2 g S) = 7,5 g
Referencer
- Foist L. (2019). Lov om gensidig andel: definition og eksempler. Undersøgelse. Gendannet fra: study.com
- Cyberopgaver. (2016, 9. februar). Lov om gensidige proportioner eller Richter-Wenzel. Gendannet fra: cibertareas.infol
- Wikipedia. (2018). Lov om gensidige proportioner. Gendannet fra: en.wikipedia.org
- J.R. Partington M.B.E. D.Sc. (1953) Jeremias Benjamin Richter og loven om gensidige proportioner.-II, Annals of Science, 9: 4, 289-314, DOI: 10.1080 / 00033795300200233
- Shrestha B. (18. juni 2015). Lov om gensidige proportioner. Kemi Libretexts. Gendannet fra: chem.libretexts.org
- Omdefinere viden. (29. juli 2017). Lov om gensidige proportioner. Gendannet fra: hemantmore.org.in



Endnu ingen kommentarer