
Arsen trioxid (As2O3) struktur, egenskaber og anvendelser
Det arsen trioxid er en uorganisk forbindelse, hvis kemiske formel er AstoELLER3. Arsen i sin metalliske tilstand omdannes hurtigt til dette oxid, som er en meget giftig gift, der kan have akutte og kroniske manifestationer..
Da arsen og ilt er elementer i p-blokken, med en relativt lav elektronegativitetsforskel, forventes det, at AstoELLER3 er sammensat af en kovalent natur; det vil sige, at As-O-bindingerne dominerer i sit faste stof over de elektrostatiske interaktioner mellem As-ionerne3+ migto-.

Akut forgiftning med arsen trioxid forekommer ved indtagelse eller indånding, hvis vigtigste manifestationer er: alvorlige gastrointestinale lidelser, kramper, kredsløbssvigt og lungeødem..
På trods af dets toksicitet er det imidlertid blevet brugt industrielt; for eksempel i konservering af træ, i produktionen af pigmenter, halvledere osv. Ligeledes blev det tidligere brugt til behandling af mange sygdomme.
Arsentrioxid er en amfoter forbindelse, opløselig i fortyndede syrer og baser, uopløselig i organiske opløsningsmidler og relativt opløselig i vand. Det forekommer som et fast stof (topbillede) med to krystallinske former: kubisk og monoklinisk.
Artikelindeks
- 1 Struktur af arsentrioxid
- 1.1 Claudetite
- 1.2 Flydende og luftformig
- 1.3 Arsenolit
- 2 egenskaber
- 2.1 Handelsnavne
- 2.2 Molekylvægt
- 2.3 Fysisk udseende
- 2.4 Lugt
- 2.5 Smag
- 2.6 Kogepunkt
- 2.7 Smeltepunkt
- 2.8 Flammepunkt
- 2.9 Opløselighed i vand
- 2.10 Opløselighed
- 2.11 Tæthed
- 2.12 Damptryk
- 2.13 Nedbrydning
- 2.14 Korrosivitet
- 2.15 Fordampningsvarme
- 2.16 Dissociationskonstant (Ka)
- 2.17 Brydningsindeks
- 3 Reaktivitet
- 4 Nomenklatur
- 5 anvendelser
- 5.1 Industriel
- 5.2 Læger
- 6 Referencer
Struktur af arsen trioxid
Claudetita
Ved stuetemperatur, AstoELLER3 krystalliserer til to monokliniske polymorfe, der begge findes i mineralet claudetit. De har trigonale pyramidenheder AsO3, som er forbundet med deres iltatomer for at kompensere for enhedens elektroniske mangel alene.
I en polymorf AsO-enheder3 de er sammenkædede og danner rækker (claudetite I), og i den anden er de forbundet som om de væver et net (claudetite II):
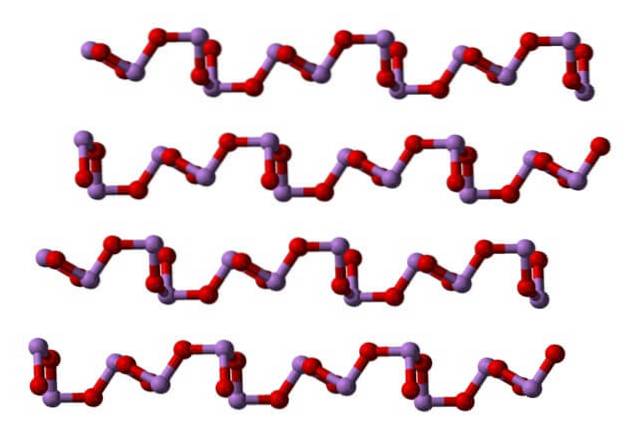
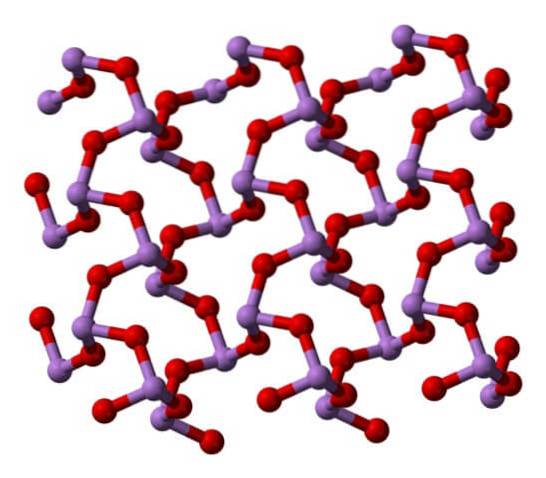
Flydende og luftformig
Når alle de strukturer, der definerer monokliniske krystaller, opvarmes, er vibrationerne således, at flere As-O-bindinger brydes, og et mindre molekyle ender med at være fremherskende: Som4ELLER6. Dens struktur er vist på billedet nedenfor.

Det kunne siges at bestå af en dimer af AstoELLER3. Dens stabilitet er sådan, at den understøtter 800 ° C i gasfasen; men over denne temperatur fragmenteres den i As-molekylertoELLER3.
Arsenolit
Det samme es4ELLER6 kan interagere med hinanden for at krystallisere til et kubisk fast stof, hvis struktur findes i mineralet arsenolit.
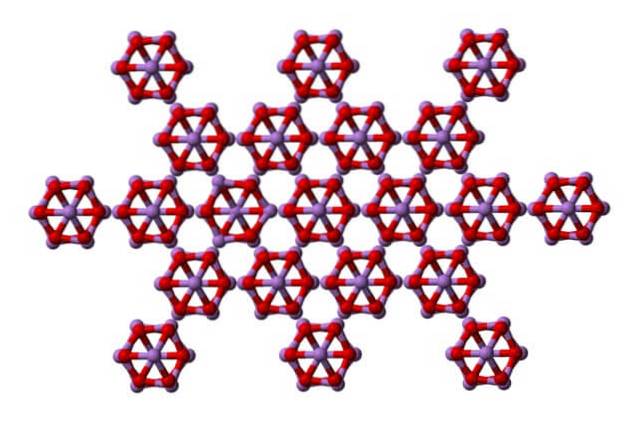
Bemærk, at billedet viser strukturen fra et højere plan. Sammenlignet med claudetit er dens strukturelle forskel med arsenolit tydelig. Her er de diskrete molekyler af As4ELLER6 at enheder vedligeholdes af Van der Waals styrker.
Ejendomme
Handelsnavne
-Arsenolit
-Arsodent
-Trisenox
-Claudetita
Molekylær vægt
197,84 g / mol.
Fysisk fremtoning
-Hvide kubiske krystaller (arsenolit).
-Farveløse monokliniske krystaller (Claudetite).
-Hvide eller gennemsigtige faste, glasagtige, amorfe klumper eller krystallinsk pulver.
Lugt
Toilet.
Smag
Smagløs.
Kogepunkt
460 ºC.
Smeltepunkt
-313 ºC (Claudetite).
-274 ºC (Arsenolit).
antændelsespunkt
485 º C (sublimerer).
Vandopløselighed
17 g / L ved 18 ° C (20 g / L ved 25 ° C).
Opløselighed
Opløselig i syrer (især saltsyre) og baser. Praktisk talt uopløselig i chloroform og ether.
Massefylde
-3,85 g / cm3 (kubiske krystaller);
-4,15 g / cm3 (rombekrystaller).
Damptryk
2,47 10-4 mmHg ved 25 ºC.
Nedbrydning
Det er ikke brændbart, men ved opvarmning kan det skabe giftig røg, der kan omfatte arsine..
Ætsende
I nærvær af fugt kan det ætse metaller.
Fordampningsvarme
77 kJ / mol.
Dissociationskonstant (Ka)
1.110-4 ved 25 ºC.
Brydningsindeks
-1.755 (Arsenolit)
-1.92-2.01 (Claudetite).
Reaktivitet
-Arsentrioxid er en amfoter forbindelse, men den fungerer fortrinsvis som en syre.
-Kan reagere med saltsyre eller flussyre og danne arsen trichlorid eller arsen trifluorid.
-Ligeledes reagerer det med stærke oxidanter, såsom salpetersyre, der forårsager arsen syre og lattergas..
-Arsentrioxid kan reagere med salpetersyre og producere arsin eller grundstoffet arsen afhængigt af reaktionsbetingelserne..
EstoELLER3 + 6 Zn + 12 HNO3 => 2 AsH3 + 6 Zn (NO3)to + 3 HtoELLER.
Denne reaktion tjente som grundlaget for oprettelsen af Marsh Test, der blev brugt til at opdage arsenforgiftning..
Nomenklatur
PåtoELLER3 Det kan navngives i henhold til følgende nomenklaturer, idet man ved, at arsen arbejder med valens +3:
-Arsenøs oxid (traditionel nomenklatur).
-Arsen (III) oxid (bestandnomenklatur).
-Diarsen trioxid (systematisk nomenklatur).
Ansøgninger
Industriel
-Det bruges til fremstilling af glas, specifikt som blegemiddel. Det bruges også til fremstilling af keramik, elektroniske produkter og fyrværkeri.
-Det tilsættes som en mindre komponent til kobberbaserede legeringer for at øge korrosionsbestandigheden af legeringsmetallerne.
-EssettoELLER3 er udgangsmaterialet til fremstilling af elementært arsen, til forbedring af elektriske forbindelser og til produktion af arsenid halvledere
-EssettoELLER3, såvel som kobberarsenat bruges de som træbeskyttelsesmidler. Det blev brugt i kombination med kobberacetat til at fremstille det Paris-grønne pigment, der blev brugt til at fremstille maling og rodenticider..
Læger
-Arsentrioxid er en forbindelse, der er blevet brugt i århundreder til behandling af mange sygdomme. Det blev brugt som en tonic til behandling af ernæringsforstyrrelser, neuralgi, gigt, gigt, astma, chorea, malaria, syfilis og tuberkulose.
-Ligeledes er det blevet brugt til lokal behandling af hudsygdomme og er blevet brugt til at ødelægge overfladiske epiteliomer..
-Fowlers opløsning blev brugt til behandling af hudsygdomme og leukæmi. Brug af dette lægemiddel er ophørt..
-I 1970'erne gennemførte den kinesiske forsker Zhang Tingdong forskning i anvendelsen af arsen trioxid til behandling af akut promyelocytisk leukæmi (APL). Hvilket førte til produktionen af lægemidlet Trisenox, som blev godkendt af den amerikanske FDA.
-Trisenox er blevet anvendt til APL-patienter, der ikke reagerer på "førstelinjebehandling", der består af all-trans retinsyre (ATRA). Arsentrioxid har vist sig at inducere kræftceller til at gennemgå apoptose.
-Trisenox anvendes som en cytostatikum til behandling af den ildfaste promyelocytiske undertype (M3) af APL.
Referencer
- Shen et al. (2001). Undersøgelser af den kliniske effekt og farmakokinetik af lavdosis arsentrioxid til behandling af recidiverende akut promyelocytisk leukæmi: en sammenligning med konventionel dosering. Leukæmi 15, 735-741.
- Science Direct. (2014). Arsentrioxid. Sevier. Gendannet fra: sciencedirect.com
- Wikipedia. (2019). Arsen trioxid. Gendannet fra: en.wikipedia.org
- PubChem. (2019). Arsen (III) oxid. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Deborah M. Rusta og Steven L. Soignetb. (2001). Risiko / fordel-profil af arsen trioxid. Onkologen vol. 6 Supplement 2 29-32.
- New England Journal of Medicine. (11. juli 2013). Retinsyre og arsentrioxid til akut promyelocytisk leukæmi. n engl j med 369; 2.



Endnu ingen kommentarer