
Atomvolumen, hvordan det varierer i det periodiske system og eksempler
Det atomvolumen er en relativ værdi, der angiver forholdet mellem den molære masse af et element og dets densitet. Så dette volumen afhænger af elementets tæthed, og densiteten afhænger igen af fasen og hvordan atomerne er arrangeret i den..
Så atomvolumenet for et element Z er ikke det samme i en anden fase end den, det udviser ved stuetemperatur (flydende, fast eller gasformig), eller når det er en del af visse forbindelser. Atomvolumenet af Z i forbindelse ZA er således forskelligt fra det for Z i forbindelse ZB.

Hvorfor? For at forstå det er det nødvendigt at sammenligne atomer med for eksempel marmor. Kuglerne har, ligesom de blålige på billedet ovenfor, en meget veldefineret materiel kant, som kan ses takket være deres skinnende overflade. I modsætning hertil er atomernes grænse diffus, selvom de kan betragtes som eksternt sfæriske.
Det, der bestemmer et punkt ud over atomgrænsen, er således nul sandsynligheden for at finde en elektron, og dette punkt kan være længere eller tættere på kernen afhængigt af, hvor mange nærliggende atomer der interagerer omkring det pågældende atom..
Artikelindeks
- 1 Atomvolumen og radius
- 2 Yderligere formel
- 3 Hvordan varierer atomvolumenet i det periodiske system?
- 3.1 Atomvolumener af overgangsmetaller
- 4 eksempler
- 4.1 Eksempel 1
- 4.2 Eksempel 2
- 5 Referencer
Atomisk volumen og radius
Ved at interagere med to H-atomer i H-molekyletto, positionerne for deres kerner er defineret såvel som afstandene imellem dem (internukleare afstande). Hvis begge atomer er sfæriske, er radius afstanden mellem kernen og den uklare grænse:
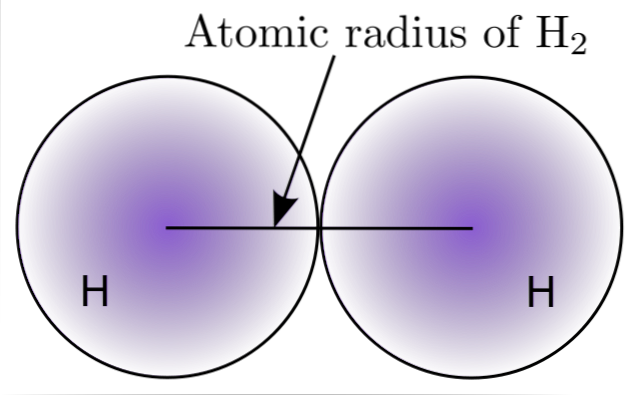
På billedet ovenfor kan du se, hvordan sandsynligheden for at finde en elektron falder, når den bevæger sig væk fra kernen. Derefter opnås atomradius ved at dividere den indre kerneafstand med to. Dernæst antages en sfærisk geometri for atomerne, og formlen bruges til at beregne volumenet af en kugle:
V = (4/3) (Pi) r3
I dette udtryk er r den atomare radius, der er bestemt for H-molekyletto. Værdien af V beregnet ved denne upræcise metode kan ændre sig, hvis f.eks. H betragtesto i flydende eller metallisk tilstand. Denne metode er imidlertid meget unøjagtig, fordi atomernes former er meget langt fra den ideelle sfære i deres interaktioner..
For at bestemme atomvoluminerne i faste stoffer tages der højde for mange variabler, der vedrører arrangementet, og som opnås ved røntgendiffraktionsundersøgelser..
Yderligere formel
Molær masse udtrykker den mængde stof, der har et mol atomer af et kemisk element.
Dens enheder er g / mol. På den anden side er densitet det volumen, som et gram af elementet optager: g / ml. Da enhederne med atomvolumen er ml / mol, skal du lege med variablerne for at nå frem til de ønskede enheder:
(g / mol) (ml / g) = ml / mol
Eller hvad er det samme:
(Molær masse) (1 / D) = V
(Molær masse / D) = V
Således kan volumenet af en mol atomer af et element let beregnes; mens der med formlen for det sfæriske volumen beregnes volumenet af et individuelt atom. For at nå frem til denne værdi fra den første er en konvertering nødvendig gennem Avogadros nummer (6.02 · 10-2. 3).
Hvordan varierer atomvolumenet i det periodiske system?
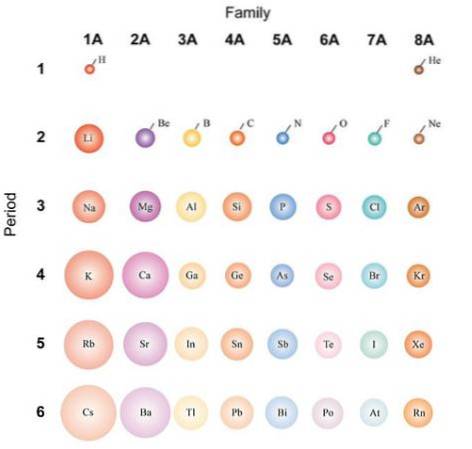
Hvis atomerne betragtes som sfæriske, vil deres variation være den samme som observeret i atomradier. På billedet ovenfor, som viser repræsentative elementer, er det illustreret, at atomerne fra højre til venstre bliver mindre; i stedet bliver de fra top til bund mere voluminøse.
Dette skyldes, at kernen i samme periode inkorporerer protoner, når den bevæger sig til højre. Disse protoner udøver en tiltrækkende kraft på de eksterne elektroner, der føler en effektiv nuklear ladning Zef, mindre end den faktiske nukleare ladning Z.
Elektronerne fra de indre skaller afviser de fra den ydre skal, hvilket reducerer kernens virkning på dem; dette er kendt som skærmeffekten. I samme periode kan skærmeffekten ikke modvirke stigningen i antallet af protoner, så elektronerne i den indre skal forhindrer ikke atomer i at trække sig sammen..
At falde ned i en gruppe muliggør dog nye energiniveauer, som gør det muligt for elektroner at kredser længere væk fra kernen. Ligeledes øges antallet af elektroner i den indre skal, hvis afskærmningseffekter begynder at blive mindre, hvis kernen tilføjer protoner igen..
Af disse grunde forstås det, at gruppe 1A har de mest voluminøse atomer, i modsætning til de små atomer i gruppe 8A (eller 18), de ædle gasser..
Atomvolumener af overgangsmetaller
Overgangsmetalatomer inkorporerer elektroner i indre d orbitaler. Denne stigning i skærmeffekten og, såvel som i den virkelige nukleare ladning Z, annulleres næsten ens, så deres atomer bevarer samme størrelse i samme periode..
Med andre ord: i en periode udviser overgangsmetaller lignende atomvolumener. Disse små forskelle er imidlertid enormt vigtige, når man definerer metalliske krystaller (som om de var metalliske kugler).
Eksempler
To matematiske formler er tilgængelige til at beregne atomvolumenet for et element, hver med dets tilsvarende eksempler.
Eksempel 1
Givet atomradius for brint -37 pm (1 picometer = 10-12m) - og cæsium -265 pm-, beregne deres atomvolumen.
Ved hjælp af den sfæriske volumenformel har vi derefter:
VH= (4/3) (3.14) (37 pm)3= 212.07 pm3
VCs= (4/3) (3.14) (265 pm)3= 77912297,67 pm3
Imidlertid er disse volumener udtrykt i picometre ublu, så de omdannes til enheder af angstrømmer, gangende dem med konverteringsfaktoren (1Å / 100pm)3:
(212.07 pm3) (1Å / 100pm)3= 2.1207 × 10-4 TIL3
(77912297.67 pm3) (1Å / 100pm)3= 77,912 Å3
Således er forskellene i størrelse mellem det lille H-atom og det omfangsrige Cs-atom bevist numerisk. Det skal huskes, at disse beregninger kun er tilnærmelser under påstanden om, at et atom er totalt sfærisk, der vandrer foran virkeligheden.
Eksempel 2

Densiteten af rent guld er 19,32 g / ml, og dens molære masse er 196,97 g / mol. Ved anvendelse af M / D-formlen til beregning af volumenet af en mol guldatomer opnås følgende:
VAu= (196,97 g / mol) / (19,32 g / ml) = 10,19 ml / mol
Det vil sige, 1 mol guldatomer optager 10,19 ml, men hvilket volumen optager et guldatom specifikt? Og hvordan man udtrykker det i enheder af pm3? Til dette skal du blot anvende følgende konverteringsfaktorer:
(10,19 ml / mol) · (mol / 6,02 · 10-2. 3 atomer) · (1 m / 100 cm)3(13.00 / 10-12m)3= 16,92 · 106 om eftermiddagen3
På den anden side er atomradiusen af guld 166 pm. Hvis begge volumener sammenlignes - den, der er opnået ved den foregående metode, og den, der beregnes med den sfæriske volumenformel - vil det blive fundet, at de ikke har den samme værdi:
VAu= (4/3) (3.14) (166 pm)3= 19.15 · 106 om eftermiddagen3
Hvilken af de to er tættest på den accepterede værdi? Den der er tættest på de eksperimentelle resultater opnået ved røntgendiffraktion af krystalstrukturen af guld.
Referencer
- Helmenstine, Anne Marie, Ph.D. (9. december 2017). Atomic Volume Definition. Hentet den 6. juni 2018 fra: thoughtco.com
- Mayfair, Andrew. (13. marts 2018). Sådan beregnes volumenet af et atom. Videnskabelig. Hentet den 6. juni 2018 fra: sciencing.com
- Wiki Kids Ltd. (2018). Lothar Meyer Atomic Volume Curves. Hentet den 6. juni 2018 fra: wonderwhizkids.com
- Lumen. Periodiske tendenser: Atomic Radius. Hentet den 6. juni 2018 fra: courses.lumenlearning.com
- Camilo J. Derpich. Atomvolumen og densitet. Hentet den 6. juni 2018 fra: es-puraquimica.weebly.com
- Whitten, Davis, Peck & Stanley. Kemi. (8. udgave). CENGAGE Learning, s 222-224.
- CK-12 Foundation. (22. februar 2010). Sammenlignende atomstørrelser. [Figur]. Hentet den 6. juni 2018 fra: commons.wikimedia.org
- CK-12 Foundation. Udgave (22. februar 2010). Atomisk radius af Hto. [Figur]. Hentet den 6. juni 2018 fra: commons.wikimedia.org



Endnu ingen kommentarer