
Svovloxidformel, egenskaber, risici og anvendelser

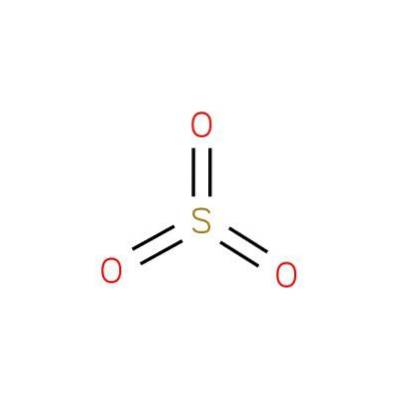
Det svovloxid (VI), også kendt som svovltrioxid eller svovlsyreanhydrid, er en kemisk forbindelse med formlen SO3. Dens struktur er præsenteret i figur 1 (EMBL-EBI, 2016).
Svoveltrioxid produceres i fortyndet gasform i en kontaktproces svovlsyreanlæg gennem oxidation af gasser, der indeholder svovldioxid..
Indtil nu er det eneste præparat af ren svovltrioxid fra gasser indeholdende SO3 fortyndet, har været en pilotanlægskala proces, der involverer kryoskopisk kondens.
Den sædvanlige procedure involverer i stedet destillation af oleum. Den varme, der kræves til oleumdestillation, leveres mest bekvemt af varm kontaktgas fra det tilknyttede svovlsyreanlæg..
Det kan fremstilles i laboratoriet ved opvarmning af røgende svovlsyre og opsamling af sublimatet i en afkølet modtager. Hvis dampen kondenserer over 27 ° C, opnås gamma-formen som en væske.
Hvis dampen kondenserer under 27 ° C og i nærværelse af et spor af fugtighed, opnås en blanding af de tre former. De 3 former kan adskilles ved fraktioneret destillation.
Svovloxids fysiske og kemiske egenskaber
Svovletrioxid er formet som hvide nåle, der bliver til røg i luften. Ofte stødt på hæmmere for at forhindre polymerisering (National Center for Biotechnology Information, 2017).
Dens molekylvægt er 80,066 g / mol, dens densitet er 1,92 g / cm³ g / ml, og dens smelte- og kogepunkter er henholdsvis 16,8 ºC og 44,7 ºC. (Royal Society of Chemistry, 2015).
Forbindelsen kombineres med vand med eksplosiv kraft og danner svovlsyre på grund af dets surhed. Svovltrioxid karboniserer organiske stoffer.
Svoveltrioxid absorberer hurtigt fugt og udsender tætte hvide dampe. Opløsninger af trioxiden i svovlsyre kaldes røgende svovlsyre eller oleum. (Svovltrioxid, 2016).
Reaktionen af svoveltrioxid og iltdifluorid er meget kraftig, og eksplosioner opstår, hvis reaktionen udføres i fravær af et opløsningsmiddel. Omsætning af overskydende svovltrioxid med tetrafluorethylen forårsager eksplosiv nedbrydning af carbonylfluorid og svovldioxid..
Omsætningen af vandfri perchlorsyre med svovltrioxid er voldsom og ledsages af udviklingen af betydelig varme. Flydende svovltrioxid reagerer voldsomt med nitrilchlorid, selv ved 75 ° C.
Reaktionen af svoveltrioxid og blyoxid forårsager hvid luminescens. Kombinationen af iod, pyridin, svovltrioxid og formamid udviklede en gas over tryk efter flere måneder.
Dette skyldes den langsomme dannelse af svovlsyre, eksternt vand eller dehydrering af formamid til hydrogencyanid (SULFUR TRIOXIDE, S.F.).
Reaktivitet og farer
Svoveltrioxid er en stabil forbindelse, der er uforenelig med organiske materialer, fint pulveriserede metaller, baser, vand, cyanider og en lang række andre kemikalier..
Stoffet er en stærk oxidant og reagerer voldsomt med brændbare og reducerende materialer og organiske forbindelser, der forårsager brand og eksplosionsfare..
Reagerer voldsomt med vand og fugtig luft for at producere svovlsyre. Opløsningen i vand er en stærk syre, den reagerer voldsomt med baser, og de er ætsende metaller, der danner brandfarlig / eksplosiv gas.
Forbindelsen er ætsende for metaller og stoffer. Forårsager forbrændinger af øjne og hud. Indtagelse forårsager alvorlige forbrændinger i munden, spiserøret og maven. Damp er meget giftig ved indånding. (National Institute for Occupational Safety and Health, 2015)
I tilfælde af kontakt med øjnene skal du kontrollere, om du har kontaktlinser, og fjerne dem med det samme. Øjne skal skylles med rindende vand i mindst 15 minutter, så øjenlågene holdes åbne. Koldt vand kan bruges. Øjen salve bør ikke bruges.
Hvis kemikaliet kommer i kontakt med tøj, skal du fjerne det så hurtigt som muligt og beskytte dine egne hænder og krop. Anbring offeret under et sikkerhedsbrusebad.
Hvis kemikaliet akkumuleres på offerets udsatte hud, såsom hænder, vaskes den forurenede hud forsigtigt og omhyggeligt med rindende vand og ikke-slibende sæbe. Koldt vand kan bruges. Søg lægehjælp, hvis irritationen vedvarer. Vask det forurenede tøj, inden det bruges igen.
I tilfælde af indånding skal offeret få lov til at hvile i et godt ventileret område. Hvis inhalationen er svær, skal offeret evakueres til et sikkert område hurtigst muligt. Løsn stramt tøj såsom en skjortekrave, bælte eller slips.
Hvis offeret har svært ved at trække vejret, skal der gives ilt. Hvis offeret ikke trækker vejret, udføres genoplivning fra mund til mund. Husk altid, at det kan være farligt for den person, der yder hjælp til at give genoplivning fra mund til mund, når det indåndede materiale er giftigt, smitsomt eller ætsende..
I alle tilfælde bør der straks søges lægehjælp (Sikkerhedsdatablad Svovltrioxid, 2013).
Ansøgninger
Svovltrioxid er et essentielt reagens i sulfoneringsreaktioner. Disse processer tilvejebringer vaskemidler, farvestoffer og lægemidler. Fremstillet in situ fra svovlsyre eller anvendes som en brændende svovlsyreopløsning.
Luftforurening fra svovloxider er et stort miljøproblem med millioner af tons svovldioxid og trioxid, der udsendes i atmosfæren hvert år. Disse forbindelser er skadelige for plante- og dyreliv samt for mange byggematerialer.
Et andet stort problem at overveje er sur regn. Begge svovloxider opløses i atmosfæriske vanddråber for at danne syreopløsninger, der kan være meget skadelige, når de fordeles i form af regn..
Svovlsyre menes at være hovedårsagen til surhedsgrad fra sur regn, som kan beskadige skovene og få fisk til at dø i mange søer.
Sur regn er også ætsende for metaller, kalksten og andre materialer. Mulige løsninger på dette problem er dyre på grund af vanskelighederne med at fjerne svovl fra kul og olie, før de brænder (Zumdahl, 2014).
Referencer
- EMBL-EBI. (2016, 2. december). svovltrioxid. Hentet fra ChEBI: ebi.ac.uk
- Sikkerhedsdatablad Svovltrioxid. (2013, 21. maj). Hentet fra sciencelab: sciencelab.com
- National Center for Biotechnology Information. (2017, 24. juni). PubChem Compound Database; CID = 24682 . Hentet fra PubChem: pubchem.ncbi.nlm.nih.gov
- National Institute for Occupational Safety and Health. (2015, 22. juli). SVOVTRIOXID. Hentet fra cdc.gov: cdc.gov
- Royal Society of Chemistry. (2015). Svovltrioxid. Hentet fra chemspider: chemspider.com
- Svovltrioxid. (2016). Hentet fra kemikaliebog: chemicalbook.com.
- SVOVTRIOXID. (S.F.). Hentet fra CAMEO: cameochemicals.noaa.gov.
- Zumdahl, S. S. (2014, 13. februar). Hentet fra britannica: britannica.com.


Endnu ingen kommentarer