
Zinkoxid (ZnO) struktur, egenskaber, anvendelser, risici

Det Zinkoxid Det er en uorganisk forbindelse, hvis kemiske formel er ZnO. Den består udelukkende af Zn-ionerto+ migto- i forholdet 1: 1; dets krystallinske gitter kan imidlertid udgøre en ledig stilling af Oto-, hvilket giver anledning til strukturelle defekter, der kan ændre farverne på dine syntetiske krystaller.
Det erhverves kommercielt som et pulverformigt hvidt fast stof (lavere billede), der produceres direkte fra oxidationen af metallisk zink ved den franske proces; eller udsætter zinkmalm for carbothermisk reduktion på en sådan måde, at deres dampe derefter oxideres og ender med at størkne.

Andre fremgangsmåder til fremstilling af ZnO består i udfældning af dets hydroxid, Zn (OH)to, fra vandige opløsninger af zinksalte. Ligeledes kan morfologisk varierede tynde film eller nanopartikler af ZnO syntetiseres ved hjælp af mere sofistikerede teknikker såsom kemisk aflejring af dens dampe..
Dette metaloxid findes i naturen som mineral zinkit, hvis krystaller normalt er gule eller orange på grund af metalliske urenheder. ZnO-krystaller er karakteriseret ved at være piezoelektriske, termokrome, selvlysende, polære og også have et meget bredt energibånd i deres halvlederegenskaber.
Strukturelt er det isomorft til zinksulfid, ZnS, der vedtager sekskantede og kubiske krystaller svarende til henholdsvis wurzit og blende. I disse er der en vis kovalent karakter i interaktionerne mellem Znto+ migto-, hvilket forårsager en heterogen fordeling af ladninger i ZnO-krystallen.
Undersøgelser af egenskaberne og anvendelserne af ZnO strækker sig til områderne fysik, elektronik og biomedicin. Dens enkleste og mest daglige anvendelser går ubemærket hen i sammensætningen af ansigtscremer og produkter til personlig hygiejne såvel som i solcreme.
Artikelindeks
- 1 Struktur
- 1.1 Polymorfe
- 1.2 Interaktioner
- 1.3 Nanopartikelmorfologi
- 2 egenskaber
- 2.1 Fysisk udseende
- 2.2 Molær masse
- 2.3 Smeltepunkt
- 2.4 Tæthed
- 2.5 Opløselighed i vand
- 2.6 Amfoterisme
- 2.7 Varmekapacitet
- 2.8 Direkte energikløft
- 3 anvendelser
- 3.1 Lægemidler
- 3.2 Antibakteriel
- 3.3 Pigmenter og belægninger
- 3.4 Biobilleder
- 3.5 Additiv
- 3.6 Hydrogensulfidopfangere
- 4 risici
- 5 Referencer
Struktur
Polymorfe
ZnO krystalliserer under normale betingelser for tryk og temperatur i en sekskantet wurzitstruktur. I denne struktur er Zn-ionerneto+ migto- er arrangeret i skiftende lag på en sådan måde, at hver ender ender omgivet af en tetraeder med ZnO4 eller OZn4, henholdsvis.
Under anvendelse af en "skabelon" eller kubisk understøtning kan ZnO bringes til at krystallisere til en kubisk struktur af zinkblanding; som ligesom wurzit svarer til isomorfe strukturer (identiske i rummet, men med forskellige ioner) af zinksulfid, ZnS.
Ud over disse to strukturer (wurzit og blende) krystalliserer ZnO under højt tryk (ca. 10 GPa) i stensaltstrukturen, den samme som NaCl.
Interaktioner
Interaktioner mellem Znto+ migto- præsenterer en vis karakter af kovalens, så der er delvist en Zn-O kovalent binding (begge atomer med sp-hybridisering3), og på grund af tetraederens forvrængning manifesterer de et dipolmoment, der føjer til de ioniske attraktioner i ZnO-krystallerne.
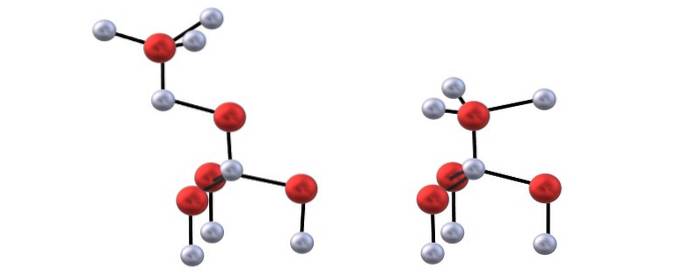
Du har det øverste billede til at visualisere tetraederne nævnt for ZnO-strukturer.
Forskellen mellem blenda- og wurzitstrukturer ligger også i det faktum, at ionerne ikke er formørket set ovenfra. For eksempel i wurzit forstås det, at de hvide kugler (Znto+) er lige over de røde kugler (Oto-). På den anden side sker det ikke i den kubiske struktur af blende, fordi der er tre lag: A, B og C i stedet for kun to.
Nanopartikelmorfologi
Selvom ZnO-krystaller har en tendens til at have sekskantede wurzitstrukturer, er morfologien for deres nanopartikler en anden historie. Afhængigt af parametrene og syntesemetoderne kan disse antage så forskellige former som stænger, plader, blade, kugler, blomster, bælter, nåle, blandt andre..
Ejendomme
Fysisk fremtoning
Hvidt, lugtfri, pulverformigt fast stof med en bitter smag. I naturen kan det findes krystalliseret med metalliske urenheder, såsom zinkitmineral. Hvis sådanne krystaller er hvide, præsenterer de termokromisme, hvilket betyder, at når de opvarmes, ændrer de deres farve: fra hvid til gul..
Ligeledes kan dets syntetiske krystaller have rødlige eller grønlige farver afhængigt af deres støkiometriske ilt-sammensætning; det vil sige hullerne eller ledige stillinger forårsaget af manglen på anioner Oto- påvirker direkte måden, hvorpå lys interagerer med ioniske netværk.
Molar masse
81,406 g / mol
Smeltepunkt
1974 ° C. Ved denne temperatur gennemgår den termisk nedbrydning, der frigiver zinkdampe og molekylært eller gasformigt ilt..
Massefylde
5,1 g / cm3
Vandopløselighed
ZnO er praktisk talt uopløselig i vand og giver næppe opløsninger med en koncentration på 0,0004% ved 18 ºC.
Amfoterisme
ZnO kan reagere med både syrer og baser. Når det reagerer med en syre i vandig opløsning, øges dets opløselighed ved at danne et opløseligt salt, hvor Znto+ ender med at kompleksere sig med vandmolekyler: [Zn (OHto)6]to+. For eksempel reagerer det med svovlsyre for at producere zinksulfat:
ZnO + HtoSW4 → ZnSO4 + HtoELLER
Tilsvarende reagerer det med fedtsyrer for at danne deres respektive salte, såsom zinkstearat og palmitat..
Og når det reagerer med en base, i nærværelse af vand, dannes zinksaltene:
ZnO + 2NaOH + HtoO → Nato[Zn (OH)4]
Varmekapacitet
40,3 J / K mol
Direkte energikløft
3.3 eV. Denne værdi gør det til en bredbånds halvleder, der er i stand til at fungere under intense elektriske felter. Det har også egenskaber ved at være en halvleder af typen n, som ikke har været i stand til at forklare grundene til, at der er et ekstra bidrag af elektroner i dets struktur.
Dette oxid er kendetegnet ved dets optiske, akustiske og elektroniske egenskaber, takket være hvilket det betragtes som en kandidat til potentielle applikationer relateret til udviklingen af optoelektroniske enheder (sensorer, laserdioder, solceller). Årsagen til sådanne egenskaber ligger uden for fysikområdet.
Ansøgninger
Medicinsk
Zinkoxid er blevet anvendt som tilsætningsstof i adskillige hvide cremer til behandling af irritationer, aknes, dermatitis, slid og revner i huden. I dette område er dets anvendelse populær til at lindre irritationer forårsaget af bleer på babyens hud..
Det er også en komponent i solcreme, fordi sammen med nanopartiklerne af titandioxid, TiOto, Det hjælper med at blokere solens ultraviolette stråling, ligesom det fungerer som et fortykningsmiddel, og det er derfor, det findes i bestemt lys make-up, lotioner, emaljer, talkum og sæber..
På den anden side er ZnO en kilde til zink, der anvendes i kosttilskud og vitaminprodukter såvel som i korn..
Antibakteriel
Ifølge morfologien i dets nanopartikler kan ZnO aktiveres under ultraviolet stråling for at generere hydrogenperoxider eller reaktive arter, der svækker cellemembranerne i mikroorganismer.
Når dette sker, får de resterende ZnO-nanopartikler fure cytoplasmaet og begynde at interagere med det kompendium af biomolekyler, der udgør cellen, hvilket resulterer i deres apoptose..
Derfor kan ikke alle nanopartikler bruges i solcreme-sammensætninger, men kun dem, der mangler antibakteriel aktivitet..
Produkter med denne type ZnO er designet, overtrukket med opløselige polymere materialer til behandling af infektioner, sår, sår, bakterier og endda diabetes..
Pigmenter og belægninger
Pigmentet kendt som hvidt zink er ZnO, der tilsættes forskellige malinger og belægninger for at beskytte metaloverflader, hvor de påføres mod korrosion. For eksempel anvendes belægninger med tilsat ZnO til at beskytte galvaniseret jern..
På den anden side er disse belægninger også blevet brugt på vinduesglas for at forhindre, at varmen trænger ind (hvis den er udenfor) eller kommer ind (hvis den er indeni). På samme måde beskytter det nogle polymere og tekstilmaterialer mod forringelse på grund af virkningen af solstråling og varme..
Biobilleder
Luminescensen af ZnO-nanopartikler er blevet undersøgt til brug i bioafbildning og studerer således de indre strukturer i celler gennem de blå, grønne eller orange lys, der udstråler..
Tilsætningsstof
ZnO finder også anvendelse som tilsætningsstof i gummi, cement, tandplejemateriale, glas og keramik på grund af dets lavere smeltepunkt og opfører sig derfor som et flydende middel..
Hydrogen Sulfide Eliminator
ZnO fjerner ubehagelige H-gassertoJa, hjælper med at afsvovle nogle dampe:
ZnO + HtoS → ZnS + HtoELLER
Risici
Zinkoxid som sådan er en ikke-giftig og harmløs forbindelse, så den forsigtige håndtering af dets faste stof udgør ingen risiko..
Problemet ligger imidlertid i dens røg, for selvom det ved høje temperaturer nedbrydes, forurenes zinkdampene med at forurene lungerne og forårsage en slags "metalfeber". Denne sygdom er karakteriseret ved symptomer på hoste, feber, en følelse af tæthed i brystet og en konstant metallisk smag i munden..
Det er heller ikke kræftfremkaldende, og cremer, der indeholder det, har ikke vist sig at øge zinkabsorptionen i huden, så ZnO-baserede solcreme betragtes som sikre; medmindre der er allergiske reaktioner, i hvilket tilfælde brugen skal stoppes.
Med hensyn til visse nanopartikler designet til at bekæmpe bakterier kan disse have negative virkninger, hvis de ikke transporteres korrekt til deres handlingssted..
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Wikipedia. (2019). Zinkoxid. Gendannet fra: en.wikipedia.org
- Hadis Morkoç og Ümit Özgur. (2009). Zinkoxid: grundlæggende, materialer og udstyrsteknologi. [PDF]. Gendannet fra: application.wiley-vch.de
- Parihar, M. Raja og R. Paulose. (2018). En kort gennemgang af strukturelle, elektriske og elektrokemiske egenskaber af zinkoxid-nanopartikler. [PDF]. Gendannet fra: ipme.ru
- A. Rodnyi og I. V. Khodyuk. (2011). Optiske og luminescensegenskaber af zinkoxid. Gendannet fra: arxiv.org
- Siddiqi, K. S., Ur Rahman, A., Tajuddin, & Husen, A. (2018). Egenskaber ved zinkoxid-nanopartikler og deres aktivitet mod mikrober. Nanoskala forskningsbreve, 13 (1), 141. doi: 10.1186 / s11671-018-2532-3
- Kemiske sikkerhedsfaktorer. (2019). Zinkoxid. Gendannet fra: chemicalafetyfacts.org
- Jinhuan Jiang, Jiang Pi og Jiye Cai. (2018). Fremme af zinkoxid-nanopartikler til biomedicinske applikationer. Bioinorganic Chemistry and Applications, bind. 2018, artikel-ID 1062562, 18 sider. doi.org/10.1155/2018/1062562



Endnu ingen kommentarer