
Kloroxid (V) egenskaber, struktur, anvendelser
Det kloroxid (V) er en meget ustabil uorganisk forbindelse, hvis kemiske formel er CltoELLER5. Det er en af de mange kloroxider, som er karakteriseret ved at være molekylære eller endda radikale arter.
CltoELLER5 Det har kun fundet liv i papir og teoretiske beregninger; dens eksistens er imidlertid ikke udelukket, og det er sandsynligt, at nogle kan karakteriseres (ved avancerede spektroskopiteknikker). Hvad der kan forudsiges ud fra generelle kemikoncepter for dette oxid er, at det er anhydridet af chlorsyre, HClO3.
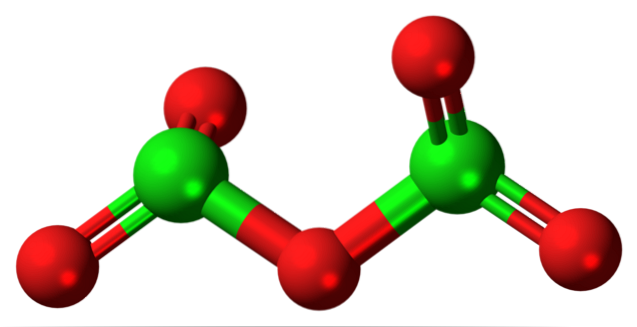
Det hypotetiske chlor (V) oxidmolekyle er vist ovenfor. Bemærk, at da det er et molekyle, overvejes tilstedeværelsen af Cl-ion slet ikke+5; endnu mindre, når det skal have en sådan polariserende kraft til at tvinge ilt til at binde kovalent.
Som alle ustabile forbindelser frigiver det energi til at nedbrydes til mere stabile produkter; proces, der i mange tilfælde er eksplosiv. Når CltoELLER5 nedbryder frigiver ClOto migto. Det teoretiseres, at i vand afhængigt af isomeren af CltoELLER5, kan danne forskellige chloroxosyrer.
Artikelindeks
- 1 egenskaber
- 2 Struktur af kloroxid (V)
- 2.1 Molekyle
- 2.2 Lewis-struktur
- 2.3 Isomerer og deres respektive hydrolyse
- 3 Nomenklatur
- 4 anvendelser
- 5 Referencer
Ejendomme
Molmassen af CltoELLER5 det er 150,9030 g / mol. Fra denne masse og dens hypotetiske molekyle kan det formodes, at hvis den kunne isoleres, ville den sandsynligvis være en olieagtig væske; naturligvis ved at sammenligne det med Cl's fysiske udseendetoELLER7.
Selvom det ikke kan isoleres eller karakteriseres, er dette chloroxid surt, kovalent og skal også have et lille dipolmoment. Dens surhed er forståelig, hvis den kemiske ligning af hydrolysen analyseres:
CltoELLER5 + HtoO 2 HCI3
At være HClO3 klorsyre. Den omvendte reaktion ville resultere i det tilfælde, at syren kan blive dehydreret:
2HClO3 => CltoELLER5 + HtoELLER
På den anden side, når CltoELLER5 næppe produceret nedbrydes det:
2CltoELLER5 => 4ClOto + ELLERto
Det er derfor en mellemliggende art snarere end et oxid korrekt. Dets nedbrydning skal være så hurtig (i betragtning af at selv CltoELLER5), som ikke er blevet detekteret ved hjælp af nuværende instrumentale analyseteknikker.
Struktur af kloroxid (V)
Molekyle
I det øverste billede blev strukturen af det hypotetiske Cl-molekyle vist.toELLER5 med en model af kugler og stænger. De røde kugler repræsenterer iltatomer, og de grønne kugler repræsenterer kloratomer. Hver klor har et trigonal pyramidemiljø, så dens hybridisering skal være sp3.
Molekylet af CltoELLER5 det kan ses som to trigonale pyramider forbundet med ilt. Men hvis du ser nøje, orienterer den ene pyramide sine iltatomer nedad, den anden ud af planet (mod læseren)..
Derfor antages det, at der er rotation i O-linkettoCl-O-ClOto, hvilket gør molekylet relativt dynamisk. Bemærk, at formlen OtoCHLOClOto er en måde at repræsentere CltoELLER5.
Lewis struktur
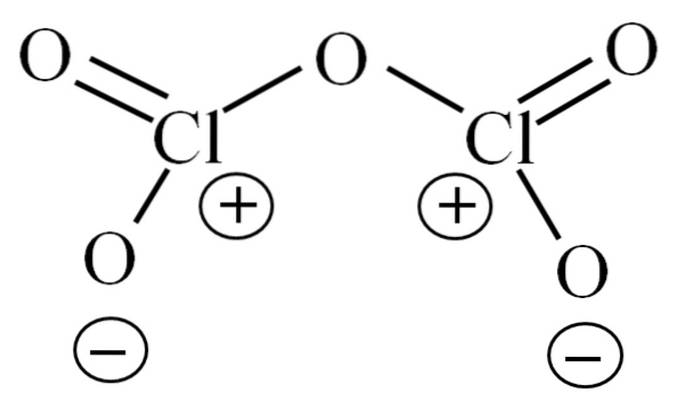
Indtil nu har molekylet i sig selv ikke gjort det muligt at dechiffrere, hvad dets ustabilitet skyldes. For at kaste lys over dette spørgsmål vender vi os til dets Lewis-struktur, der er afbildet ovenfor. Bemærk, at strukturen fejlagtigt kan antages at være flad, men i det foregående underafsnit blev det præciseret, at dette ikke er tilfældet..
Hvorfor har begge kloratomer positive formelle ladninger? Fordi klor har et frit par elektroner tilbage, hvilket kan verificeres ved at anvende Valencia Bond Theory (som ikke vil blive gjort her for at forenkle formål). Dens formelle belastning er således:
CF = 7 - (4 + 2) = 1
Og hvad har dette at gøre med deres ustabilitet? Nå, klor er betydeligt elektronegativ og derfor en dårlig bærer af positive formelle ladninger. Dette vender tilbage til CltoELLER5 en meget sur art, da den har brug for at få elektroner til at levere den elektroniske efterspørgsel efter de to klorer.
Det modsatte sker med BrtoELLER5 og jegtoELLER5, oxider, der findes under normale forhold. Dette skyldes, at både brom og iod er mindre elektronegative end klor; og derfor støtter de bedre den positive formelle anklage.
Isomerer og deres respektive hydrolyse
Indtil videre er hele forklaringen faldet på en af de to isomerer af CltoELLER5: OtoCHLOClOto. Hvilken er den anden? O3CHLOClO. I denne isomer mangler klorerne formelle positive ladninger og bør derfor være et mere stabilt molekyle. Imidlertid begge OtoCHLOClOto ligesom O3ClOClO skal gennemgå hydrolysereaktioner:
ELLERtoCl-O-ClOto + HtoO => 2OtoCl-OH (som ikke er mere end HCI3)
ELLER3Cl-O-ClO + HtoO => O3Cl-OH (HCI4) + HO-ClO (HCIto)
Bemærk, at der kan dannes op til tre chloroxosyrer: HClO3, HC14 og HClOto
Nomenklatur
Navnet 'kloroxid (V)' svarer til det, der er tildelt i henhold til lagernomenklaturen. CltoELLER5 Det kan også have to andre navne: dichlorpentaoxid og kloranhydrid tildelt henholdsvis de systematiske og traditionelle nomenklaturer..
Ansøgninger
Mere end motiverende beregningsstudier, CltoELLER5 Det vil ikke blive brugt før opdaget, isoleret, karakteriseret, opbevaret og vist, at det ikke eksploderer ved den mindste kontakt..
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Sandra Luján Quiroga og Luis José Perissinotti. (2011). Kloroxosyrer og struktur af dichloroxider. Chem. Pædagog, bind 16.
- Kemisk formulering. (2019). Kloroxid (V). Gendannet fra: formulacionquimica.com
- Linus Pauling. (1988). Generel kemi. Dover Publications, INC., New York.
- Richard C. Ropp. (2013). Encyclopædi af de alkaliske jordforbindelser. Elsevier.



Endnu ingen kommentarer