
50 eksempler på syrer og baser

Der er hundreder eksempler på syrer og baser der findes i alle kemiske grene, men som som helhed er opdelt i to store familier: uorganisk og organisk. Uorganiske syrer er normalt kendt som mineralsyrer, der er kendetegnet ved at være særligt stærke sammenlignet med organiske..
Syrer og baser forstås som stoffer, der har henholdsvis sur eller saponaceous smag. Begge er ætsende, selvom ordet 'ætsende' ofte bruges om stærke baser. Bundlinje: de brænder og korroderer huden, hvis den er berørt Dens egenskaber i opløsende medier har styret en række definitioner gennem historien..
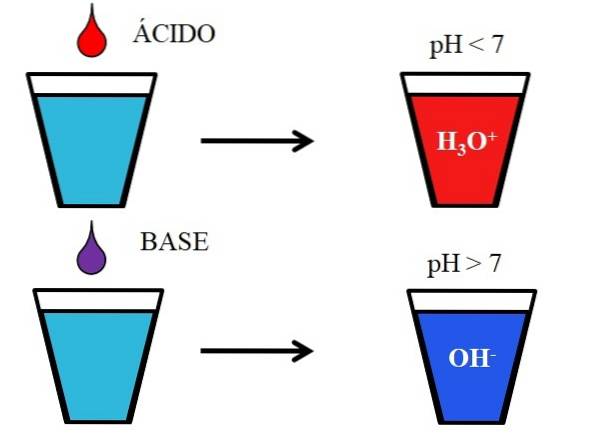
Billedet nedenfor viser den generiske opførsel af syrer og baser, når de tilsættes eller opløses i et glas vand. Syrer producerer opløsninger med pH-værdier under 7 på grund af hydroniumioner, H3ELLER+; mens baserne producerer opløsninger med en pH over 7 på grund af hydroxyl- (eller hydroxyl) -ionerne, OH-.
Hvis vi tilføjer saltsyre, HCI (rød dråbe) til glasset, vil der være H-ioner3ELLER+ og Cl- hydreret. På den anden side, hvis vi gentager eksperimentet med natriumhydroxid, NaOH (lilla dråbe), har vi OH-ioner- og Na+.
Artikelindeks
- 1 Definitioner
- 1.1 Arrhenius
- 1.2 Bronsted-Lowry
- 1.3 Lewis
- 2 Eksempler på syrer
- 3 Eksempler på baser
- 4 Referencer
Definitioner

De i stigende grad studerede og forståede egenskaber ved syrer og baser etablerede mere end en definition for disse kemiske forbindelser. Blandt disse definitioner har vi Arrhenius, Bronsted-Lowrys og endelig Lewis. Inden eksemplerne nævnes, er det nødvendigt at være klar over dette.
Arrhenius
Syrer og baser er ifølge Arrhenius dem, der, når de opløses i vand, producerer H-ioner3ELLER+ eller OH-, henholdsvis. Det vil sige, billedet repræsenterer allerede denne definition. Imidlertid forsømmer den i sig selv nogle syrer eller baser, der er for svage til at producere sådanne ioner. Det er her Bronsted-Lowry-definitionen kommer ind..
Bronsted-Lowry
Bronsted-Lowry-syrer er dem, der kan donere H-ioner+, og baserne er dem, der accepterer disse H+. Hvis en syre meget let donerer sin H+, betyder, at det er en stærk syre. Det samme sker med baserne, men ved at acceptere H+.
Således har vi stærke eller svage syrer og baser, og deres kræfter måles i forskellige opløsningsmidler; især i vand, hvorfra de kendte pH-enheder er etableret (fra 0 til 14).
Derfor vil en stærk syre-HA fuldt ud donere din H+ til vand i en reaktion af typen:
HA + HtoO => A- + H3ELLER+
Hvorhen- er den konjugerede base af HA. Derfor kommer H3ELLER+ findes i glasset med syreopløsning.
I mellemtiden vil en svag base B deprotonere vandet for at få sit respektive H+:
B + HtoELLER <=> HB + OH-
Hvor HB er den konjugerede syre af B. Dette er tilfældet med ammoniak, NH3:
NH3 + HtoELLER <=> NH4+ + Åh-
En meget stærk base kan direkte donere OH-ioner- uden behov for at reagere med vand ligesom NaOH.
Lewis
Endelig er Lewis-syrer dem, der vinder eller accepterer elektroner, og Lewis-baser er dem, der donerer eller mister elektroner..
For eksempel Bronsted-Lowry NH-basen3 Det er også en Lewis-base, da nitrogenatomet accepterer et H+ ved at donere sit par frie elektroner (H3N: H+). Derfor er de tre definitioner ikke uenige med hinanden, men snarere sammenflettede og hjælper med at studere surhed og basicitet i et bredere spektrum af kemiske forbindelser..
Eksempler på syrer
Efter at have afklaret definitionerne, vil en række syrer med deres respektive formler og navne blive nævnt nedenfor:
-HF: flussyre
-HBr: brombrintesyre
-HI: hydroiodsyre
-HtoS: hydrogensulfid
-HtoSe: saltsyre
-HtoTe: saltsyre
Dette er de binære syrer, også kaldet saltsyrer, hvortil den førnævnte saltsyre, HCI tilhører.
-HNO3: salpetersyre
-HNOto: salpetersyre
-HNO: hyponitrøs syre
-HtoCO3: kulsyre
-HtoCOto: kulsyre, som faktisk er bedre kendt under navnet myresyre, HCOOH, den enkleste organiske syre af alle
-H3PO4: phosphorsyre
-H3PO3 eller Hto[HPO3]: phosphorsyre med en HP-binding
-H3POto eller H [HtoPOto]: hypophosphorsyre med to HP bindinger
-HtoSW4: svovlsyre
-HtoSW3: svovlsyre
-HtoStoELLER7: svovlsyre
-HIO4: periodisk syre
-HIO3: jodsyre
-HIOto: jodsyre
-HIO: hypoiodinsyre
-HtoCrO4: kromsyre
-HMnO4: mangansyre
-CH3COOH: eddikesyre (eddike)
-CH3SW3H: methansulfonsyre
Alle disse syrer, undtagen myresyre og de sidste to, er kendt som oxacids eller ternære syrer..
Andre:
-AlCl3: aluminiumchlorid
-FeCl3: jernchlorid
-BF3: bortrifluorid
-Metalliske kationer opløst i vand
-Karbokationer
-H (CHBelleveClelleve): supersyre carboran
- FSO3H: fluorsulfonsyre
- HSbF6: fluorantimonsyre
- FSO3H SbF5: magisk syre
De sidste fire eksempler udgør de frygtindgydende supersyrer; forbindelser, der er i stand til at desintegrere næsten ethvert materiale bare ved at røre ved det. AlCl3 er et eksempel på Lewis-syre, da metalcentret i aluminium er i stand til at acceptere elektroner på grund af dets elektroniske mangel (det fuldender ikke sin valensoktet).
Eksempler på baser
Blandt de uorganiske baser har vi metalhydroxider, såsom natriumhydroxid, og nogle molekylære hydrider, såsom allerede nævnt ammoniak. Her er andre eksempler på baser:
-KOH: kaliumhydroxid
-LiOH: lithiumhydroxid
-RbOH: rubidiumhydroxid
-CsOH: cæsiumhydroxid
-FrOH: franciumhydroxid
-Vær (OH)to: berylliumhydroxid
-Mg (OH)to: magnesiumhydroxid
-Ca (OH)to: calciumhydroxid
-Sr (OH)to: strontiumhydroxid
-Ba (OH)to: bariumhydroxid
-Ra (OH)to: radiumhydroxid
-Fe (OH)to: jernholdigt hydroxid
-Fe (OH)3: jernhydroxid
-Al (OH)3: aluminiumhydroxid
-Pb (OH)4: blyhydroxid
-Zn (OH)to: zinkhydroxid
-Cd (OH)to: cadmiumhydroxid
-Cu (OH)to: kobberhydroxid
-Ti (OH)4: titanisk hydroxid
-PH3: fosfin
-Aske3: arsine
-NaNHto: natriumamid
- C5H5N: pyridin
-(CH3N: trimethylamin
- C6H5NHto: phenylamin eller anilin
-NaH: natriumhydrid
-KH: kaliumhydrid
-Carbanions
-Li3N: lithiumnitrid
-Alkoxider
-[(CH3)toCH]toNLi: lithiumdiisopropylamid
-Diethynylbenzenanion: C6H4C4to- (den hidtil stærkeste base)
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Naomi Hennah. (10. oktober 2018). Sådan lærer du syrer, baser og salte. Gendannet fra: edu.rsc.org
- Helmenstine, Anne Marie, Ph.D. (31. august 2019). Formler for almindelige syrer og baser. Gendannet fra: thoughtco.com
- David Wood. (2019). Sammenligning af almindelige syrer og baser. Undersøgelse. Gendannet fra: study.com
- Ross Pomeroy. (23. august 2013). Verdens stærkeste syrer: Som ild og is. Gendannet fra: realclearscience.com
- Wikipedia. (2019). Diethynylbenzen dianion. Gendannet fra: en.wikipedia.org

Endnu ingen kommentarer