
Sådan beregnes molær absorptionsevne og løste øvelser
Det molær absorptionsevne det er en kemisk egenskab, der indikerer, hvor meget lys en art kan absorbere i opløsning. Dette koncept er meget vigtigt inden for den spektroskopiske analyse af absorption af fotonstråling med energier i det ultraviolette og synlige område (UV-vis)..
Da lyset består af fotoner med sine egne energier (eller bølgelængder), afhængigt af den analyserede art eller blanding, kan en foton absorberes i større grad end en anden; det vil sige, at lys absorberes ved bestemte bølgelængder, der er karakteristiske for stoffet.

Værdien af molær absorptivitet er således direkte proportional med graden af lysabsorption ved en given bølgelængde. Hvis arten absorberer lidt rødt lys, vil dens absorberingsværdi være lav; hvorimod hvis der er en udtalt absorption af rødt lys, vil absorptionsevnen have en høj værdi.
En art, der absorberer rødt lys, reflekterer en grøn farve. Hvis den grønne farve er meget intens og mørk, betyder det, at der er stærk absorption af rødt lys.
Imidlertid kan nogle grønne nuancer skyldes refleksioner af forskellige serier af gule og blues, som blandes og opfattes som turkis, smaragd, glas osv..
Artikelindeks
- 1 Hvad er molær absorptionsevne??
- 1.1 Enheder
- 2 Sådan beregnes det?
- 2.1 Direkte godkendelse
- 2.2 Tegningsmetode
- 3 Løst øvelser
- 3.1 Øvelse 1
- 3.2 Øvelse 2
- 4 Referencer
Hvad er molær absorptionsevne??
Molær absorptionsevne er også kendt ved følgende betegnelser: specifik ekstinktion, molær dæmpningskoefficient, specifik absorption eller Bunsen-koefficient; Det er endda kommet til at blive navngivet på andre måder, så det har været en kilde til forvirring.
Men hvad er molær absorptionsevne nøjagtigt? Det er en konstant, der er defineret i det matematiske udtryk for Lamber-Beer-loven, og det angiver simpelthen, hvor meget den kemiske art eller blanding absorberer lys. En sådan ligning er:
A = εbc
Hvor A er absorbans af opløsningen ved en valgt bølgelængde λ; b er længden af cellen, hvor prøven, der skal analyseres, er indeholdt, og derfor er afstanden, som lyset krydser inden i opløsningen; c er koncentrationen af den absorberende art; og ε, den molære absorptionsevne.
Givet λ, udtrykt i nanometer, forbliver værdien af ε konstant; men når man ændrer værdierne af λ, det vil sige når man måler absorbanser med lys fra andre energier, ændres ε og når enten en minimums- eller maksimumsværdi.
Hvis dens maksimale værdi er kendt, εmaks, bestemmes samtidig λmaks; det lys, som arten absorberer mest:
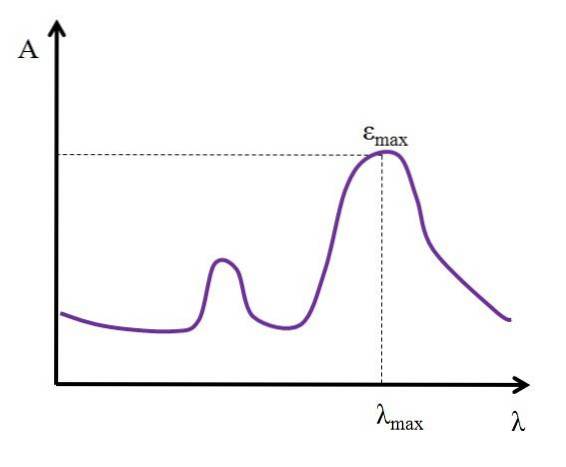
Enheder
Hvad er enhederne af ε? For at finde dem skal det være kendt, at absorbanser er dimensionsløse værdier; og derfor skal multiplikationen af enhederne b og c annulleres.
Koncentrationen af den absorberende art kan udtrykkes enten i g / L eller mol / L, og b udtrykkes normalt i cm eller m (fordi det er længden af cellen, som lysstrålen passerer igennem). Molaritet er lig med mol / L, så c udtrykkes også som M.
Ved at multiplicere enhederne b og c får vi således: M ∙ cm. Hvilke enheder skal ε have for at gøre værdien af A dimensioneløs? De der multiplicerer M ∙ cm giver en værdi på 1 (M ∙ cm x U = 1). Løsning for U, vi får simpelthen M-1∙ cm-1, som også kan skrives som: L ∙ mol-1∙ cm-1.
Brug faktisk M-enhederne-1∙ cm-1 eller L ∙ mol-1∙ cm-1 fremskynde beregninger for at bestemme molær absorptionsevne. Imidlertid udtrykkes det også ofte i enheder på mto/ mol eller cmto/ mol.
Når de udtrykkes med disse enheder, skal nogle konverteringsfaktorer bruges til at ændre enhederne af b og c.
Sådan beregnes det?
Direkte godkendelse
Molær absorptionsevne kan beregnes direkte ved at løse den i ovenstående ligning:
ε = A / bc
Hvis koncentrationen af den absorberende art, cellelængden og absorbansen opnået ved en bølgelængde er kendt, kan ε beregnes. Denne måde at beregne den på returnerer imidlertid en unøjagtig og upålidelig værdi.
Graftegningsmetode
Hvis du ser nøje på Lambert-Beer-lovligningen, vil du bemærke, at det ligner ligningen af en linje (Y = aX + b). Dette betyder, at hvis værdierne A er afbildet på Y-aksen, og værdierne af c på X-aksen, skal der opnås en lige linje, der passerer gennem oprindelsen (0,0). Således ville A blive Y, X ville være c og a ville være εb.
Når linjen er tegnet, er det derfor nok at tage to punkter til at bestemme hældningen, det vil sige a. Når dette er gjort, og længden af cellen, b, er kendt, er det let at løse for værdien af ε.
I modsætning til direkte clearance tillader graf A og c at beregne absorbansmålingerne og reducere den eksperimentelle fejl; og endvidere kan uendelige linjer passere gennem et enkelt punkt, så direkte clearance er ikke praktisk.
På samme måde kan eksperimentelle fejl få en linje til ikke at passere gennem to, tre eller flere punkter, så linjen opnået efter anvendelse af metoden med mindst kvadrat anvendes faktisk (en funktion, der allerede er indarbejdet i lommeregnerne). Alt dette forudsat høj linearitet og derfor overholdelse af Lamber-Beer-loven..
Løst øvelser
Øvelse 1
Det er kendt, at en opløsning af en organisk forbindelse med en koncentration på 0,008739 M udviste en absorbans på 0,6346 målt ved λ = 500 nm og med en cellelængde på 0,5 cm. Beregn kompleksets molære absorptionsevne ved denne bølgelængde.
Fra disse data kan ε løses direkte:
ε = 0,6346 / (0,5 cm) (0,008739M)
145,23 M-1∙ cm-1
Øvelse 2
Følgende absorbanser måles ved forskellige koncentrationer af et metalkompleks ved en bølgelængde på 460 nm og med en celle på 1 cm i længden:
A: 0,03010 0,1033 0,1584 0,3961 0,8093
c: 1,8 ∙ 10-5 6 ∙ 10-5 9.2 ∙ 10-5 2.3 ∙ 10-4 5.6 ∙ 10-4
Beregn kompleksets molære absorptionsevne.
Der er i alt fem point. For at beregne ε er det nødvendigt at tegne dem ved at placere værdierne A på Y-aksen og koncentrationerne c på X-aksen. Når dette er gjort, bestemmes den mindste kvadratlinie, og med dens ligning kan vi bestemme ε.
I dette tilfælde plotter punkterne og tegner linjen med en bestemmelseskoefficient Rto 0,9905, hældningen er lig med 7 ∙ 10-4; det vil sige εb = 7 ∙ 10-4. Derfor, med b = 1 cm, vil ε være 1428,57 M-1.cm-1 (1/7 ∙ 10-4).
Referencer
- Wikipedia. (2018). Molær dæmpningskoefficient. Gendannet fra: en.wikipedia.org
- Videnskab slog. (2018). Molær absorptionsevne. Gendannet fra: sciencestruck.com
- Kolorimetrisk analyse: (Beers lov eller spektrofotometrisk analyse). Gendannet fra: chem.ucla.edu
- Kerner N. (s.f.). Eksperiment II - Opløsningsfarve, absorbans og øl. Gendannet fra: umich.edu
- Day, R., & Underwood, A. Kvantitativ analytisk kemi (femte udgave). PEARSON Prentice Hall, s-472.
- Gonzáles M. (17. november 2010). Absorptivitet Gendannet fra: quimica.laguia2000.com


Endnu ingen kommentarer