
Acetanilid (C8H9NO) struktur, egenskaber, syntese
Det acetanilid (C8H9NO) er et aromatisk amid, der modtager flere yderligere navne: N-acetylarylamin, N-phenylacetamid og acetanil. Det præsenteres som et lugtfrit fast stof i form af flager, dets kemiske natur er amid, og som sådan kan det danne brændbare gasser, når det reagerer med stærke reduktionsmidler..
Derudover er det en svag base, der er i stand til at reagere med dehydratiserende midler såsom PtoELLER5 at give anledning til en nitril. Acetanilid viste sig at have smertestillende og antipyretisk virkning og blev brugt i 1886 under navnet Antifebrina af A. Cahn og P. Hepp..

I 1899 blev acetylsalicylsyre (aspirin) introduceret på markedet, som havde de samme terapeutiske virkninger som acetanilid. Da brugen af acetanilid var relateret til udseendet af cyanose hos patienter - en konsekvens af acetanilid-induceret methemoglobinæmi - blev anvendelsen udelukket..
Derefter blev det fastslået, at den analgetiske og antipyretiske virkning af acetanilid befandt sig i en metabolit deraf kaldet paracetamol (acetoaminophen), som ikke havde sine toksiske virkninger, som foreslået af Axelrod og Brodie..
Artikelindeks
- 1 Kemisk struktur
- 1.1 Resonansstrukturer og intermolekylære interaktioner
- 2 Kemiske egenskaber
- 2.1 Molekylvægt
- 2.2 Kemisk beskrivelse
- 2.3 Lugt
- 2.4 Smag
- 2.5 Kogepunkt
- 2.6 Smeltepunkt
- 2.7 Flammepunkt eller flammepunkt
- 2.8 Tæthed
- 2.9 Dampmassefylde
- 2.10 Damptryk
- 2.11 Stabilitet
- 2.12 Volatilitet
- 2.13 Selvantændelse
- 2.14 Nedbrydning
- 2,15 pH
- 2.16 Opløselighed
- 3 Syntese
- 4 applikationer
- 5 Referencer
Kemisk struktur
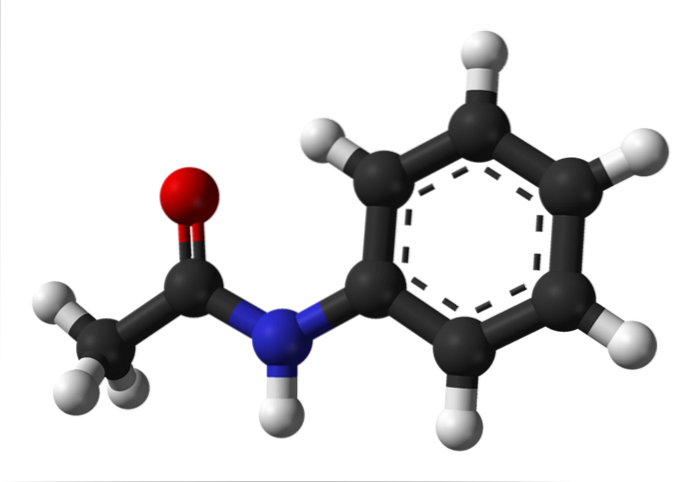
Det øverste billede repræsenterer den kemiske struktur af acetanilid. Til højre er den sekskantede aromatiske ring af benzen (med stiplede linjer), og til venstre er grunden til, at forbindelsen består af et aromatisk amid: acetamidogruppen (HNCOCH3).
Acetamidogruppen giver benzenringen en større polær karakter; det vil sige, det skaber et dipolmoment i acetanilidmolekylet.
Hvorfor? Fordi nitrogen er mere elektronegativ end noget af kulstofatomer i ringen og også er bundet til acylgruppen, hvis O-atom også tiltrækker elektrondensitet.
På den anden side hviler næsten hele den molekylære struktur af acetanilid på samme plan på grund af sp-hybridiseringto af atomerne, der komponerer det.
Der er en undtagelse knyttet til dem i -CH-gruppen3, hvis hydrogenatomer udgør hjørnerne i en tetraeder (de hvide kugler længst til venstre kommer ud af flyet).
Resonansstrukturer og intermolekylære interaktioner
Det ensomme par uden deling i N-atomet cirkulerer gennem π-systemet i den aromatiske ring, der stammer fra flere resonansstrukturer. En af disse strukturer ender imidlertid med en negativ ladning på O-atomet (mere elektronegativ) og en positiv ladning på N-atomet..
Der er således resonansstrukturer, hvor en negativ ladning bevæger sig i ringen, og en anden, hvor den befinder sig i O-atomet. Som en konsekvens af denne "elektroniske asymmetri" -som kommer hånd i hånd med molekylær asymmetri-, interagerer acetanilid intermolekylært med dipol -dipolekræfter.
Imidlertid er hydrogenbindingsinteraktioner (N-H-O- ...) mellem to acetanilidmolekyler faktisk den dominerende kraft i deres krystallinske struktur..
Således består acetanilidkrystaller af orthorhombiske enhedsceller med otte molekyler orienteret i "flad bånd" -form ved deres hydrogenbindinger..
Dette kan visualiseres ved at placere det ene acetanilidmolekyle oven på det andet parallelt. Så som HNCOCH-grupperne3 overlapper rumligt, danner de hydrogenbindinger.
Derudover kan en tredjedel mellem disse to molekyler også "glide", men med sin aromatiske ring, der peger mod den modsatte side..
Kemiske egenskaber
Molekylær vægt
135,166 g / mol.
Kemisk beskrivelse
Solid hvid eller off-white. Danner skinnende hvide flager eller et hvidt krystallinsk pulver.
Lugt
Toilet.
Smag
Lidt krydret.
Kogepunkt
304 ° C til 760 mmHg (579 ° F til 760 mmHg).
Smeltepunkt
114,3 ° C (237,7 ° F).
Flammepunkt eller flammepunkt
169 ° C (337 ° F). Måling i åbent glas.
Massefylde
1.219 mg / ml ved 15 ° C (1.219 mg / ml ved 59 ° F)
Dampmassefylde
4,65 i forhold til luft.
Damptryk
1 mmHg ved 237ºF, 1,22 × 10-3 mmHg ved 25 ° C, 2Pa ved 20 ° C.
Stabilitet
Det gennemgår en kemisk omlejring, når det udsættes for UV-lys. Hvordan ændres strukturen? Acetylgruppen danner nye bindinger på ringen i ortho- og para-positioner. Derudover er den stabil i luften og uforenelig med stærke oxidationsmidler, ætsende stoffer og baser..
Volatilitet
Mærkeligt flygtigt ved 95 ºC.
Selvantændelse
1004ºF.
Nedbrydning
Det nedbrydes ved opvarmning og udsender en meget giftig røg.
pH
5-7 (10 g / L af HtoEller ved 25 ºC)
Opløselighed
- I vand: 6,93 × 103 mg / ml ved 25 ºC.
- Opløselighed af 1 g acetanilid i forskellige væsker: i 3,4 ml alkohol, 20 ml kogende vand, 3 ml methanol, 4 ml acetone, 0,6 ml kogende alkohol, 3,7 ml chloroform, 5 ml gliecerol, 8 ml af dioxan, 47 ml benzen og 18 ml ether. Klorhydrat øger opløseligheden af acetanilid i vand.
Syntese
Det syntetiseres ved omsætning af eddikesyreanhydrid med acetanilid. Denne reaktion forekommer i mange tekster inden for organisk kemi (Vogel, 1959):
C6H5NHto + (CH3CO)toO => C6H5NHCOCH3 + CH3COOH
Ansøgninger
-Det er et hæmmermiddel ved nedbrydningsprocessen af hydrogenperoxid (hydrogenperoxid).
-Stabiliserer celluloseesterlakker.
-Det griber ind som mellemled i accelerationen af gummiproduktionen. Ligeledes er det en mellemmand i syntesen af nogle farvestoffer og kamfer..
-Fungerer som en forløber i syntesen af penicillin.
-Det bruges til fremstilling af 4-acetamidosulfonylbenzenchlorid. Acetanilid reagerer med chlorsulfonsyre (HSO3Cl), hvorved der produceres 4-aminosulfonylbenzenchlorid. Dette reagerer med ammoniak eller en primær organisk amin til dannelse af sulfonamider..
-Det blev eksperimentelt brugt i det 19. århundrede i udviklingen af fotografering.
-Acetanilid bruges som en markør for elektroosmotiske strømninger (EOF) i kapillærelektroforese til undersøgelse af sammenhængen mellem lægemidler og proteiner..
-For nylig (2016) er acetanilid blevet forbundet til 1- (ω-phenoxyalkyluracil) i eksperimenter for at hæmme replikationen af hepatitis C. Acetanilid binder til position 3 i pyrimidinringen.
-De eksperimentelle resultater indikerer en reduktion i replikationen af virusgenomet uanset viral genotype..
-Før toksiciteten af acetanilid blev identificeret, blev den brugt som smertestillende og antipyretisk middel fra 1886. Senere (1891) blev den brugt til behandling af kronisk og akut bronkitis af Grün.
Referencer
- J. Brown & D. E. C. Corbridge. (1948). Krystalstruktur af acetanilid: Brug af polariseret infrarød stråling. Naturvolumen 162, side 72. doi: 10.1038 / 162072a0.
- Grün, E. F. (1891) Anvendelsen af acetanilid til behandling af akut og kronisk bronkitis. Lancet 137 (3539): 1424-1426.
- Magri, A. et al. (2016). Udforskning af acetanilidderivater af 1- (ω-phenoxyalkyl) uracils som hidtil ukendte hæmmere af replikation af hepatitis C-virus. Sci. Rep. 6, 29487; doi: 10.1038 / srep29487.
- Merck KGaA. (2018). Acetanilid. Hentet den 5. juni 2018 fra: sigmaaldrich.com
- SIDS indledende vurderingsrapport for 13. SIAM. Acetanilid. [PDF]. Hentet den 5. juni 2018 fra: inchem.org
- Wikipedia. (2018). Acetanilid. Hentet den 5. juni 2018 fra: en.wikipedia.org
- PubChem. (2018). Acetanilid. Hentet den 5. juni 2018 fra: pubchem.ncbi.nlm.nih.gov



Endnu ingen kommentarer