
Aluminiumacetat (Al (CH3COO) 3) struktur, egenskaber, anvendelser

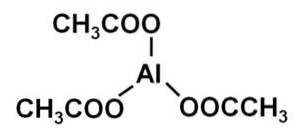
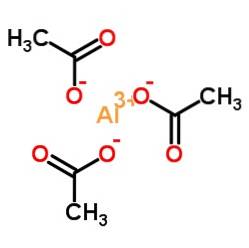
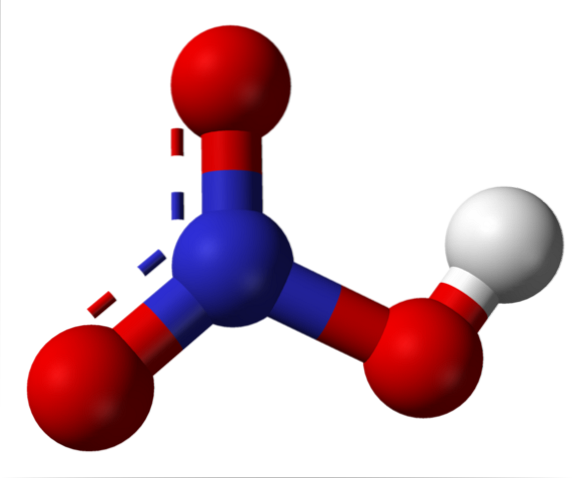
Det aluminiumacetat er en organisk forbindelse dannet af en aluminiumion Al3+ og tre acetationer CH3COO-. Dens kemiske formel er Al (CH3COO)3. Det er også kendt som aluminiumtriacetat. Det er et let hygroskopisk hvidt fast stof og opløseligt i vand..
For at opnå denne forbindelse skal der anvendes helt vandfri betingelser, dvs. fri for vand, ellers skal aluminiumdiacetatet Al (OH) (CH3COO)to.
Aluminiumacetatopløsninger har antibakterielle og antifungale egenskaber, hvorfor de siden det 19. århundrede er blevet brugt til at behandle infektioner, især i ørerne..
Den mest kendte er Burows løsning, udtænkt af en tysk læge. Imidlertid har brugen af lejlighedsvis ført til skade på mellemøret..
Denne løsning er også blevet brugt til at behandle hudproblemer såsom kløe og udslæt. Det bruges endda som solskoldning.
Aluminiumacetat og dets derivater anvendes til at opnå meget små strukturer eller partikler af aluminiumoxid AltoELLER3. Disse strukturer eller nanopartikler kan være i form af blade, blomster eller nanorør..
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Opløselighed
- 3.4 Kemiske egenskaber
- 3.5 Andre egenskaber
- 4 Opnåelse
- 5 Anvendelser inden for medicin
- 5.1 Øreinfektioner
- 5.2 Hudsygdomme
- 6 Andre anvendelser
- 6.1 Ophørt anvendelse
- 7 skadelige virkninger
- 8 Referencer
Struktur
Aluminiumtriacetat består af en aluminiumkation Al3+ og tre acetatanioner CH3COO-. Det er aluminiumsaltet af eddikesyre CH3COOH.
Aluminium er bundet til acetatanioner gennem deres ilt. Med andre ord er det knyttet til tre oxygener. Disse kryds er ioniske.
Nomenklatur
- Aluminiumacetat
- Aluminium triacetat
- Aluminiumethanoat
- Burows løsning (oversættelse fra engelsk Burows løsning): Det er en opløsning af aluminiumacetat.
Ejendomme
Fysisk tilstand
Solid hvid.
Molekylær vægt
204,11 g / mol
Opløselighed
Opløselig i vand.
Kemiske egenskaber
I vandig opløsning opløses aluminiumtriacetat og har tendens til at danne diacetat Al (OH) (CH3COO) og undertiden Al (OH) monoacetatto(CH3COO). Det hele afhænger af pH og mængden af eddikesyre CH3COOH til stede i opløsningen.
Al (CH3COO)3 + HtoO ⇔ Al (OH) (CH3COO)to + CH3COOH
Al (CH3COO)3 + 2 timertoO ⇔ Al (OH)to(CH3COO) + 2 CH3COOH
Andre egenskaber
Aluminiumacetat er let hygroskopisk, dvs. det har en tendens til at absorbere vand fra luften.
Opnåelse
Aluminiumacetat opnås fortrinsvis under strengt vandfrie betingelser, dvs. i totalt fravær af vand. Dette inkluderer også fravær af luft, da den kan indeholde fugt..
Varm en blanding af iseddikesyre CH3COOH og eddikesyreanhydrid (CH3CO)toEller under betingelser, så alt det tilstedeværende vand kan elimineres. Aluminiumchlorid AlCl tilsættes til denne varme blanding.3 vandfrit fast stof (uden vand).
Et hvidt fast stof af Al (CH3COO)3.
AlCl3 + 3 CH3COOH → Al (CH3COO)3 + 3 HCI
Det totale fravær af vand er vigtigt for at undgå dannelse af salte af aluminiummonoacetat Al (OH)to(CH3COO) og aluminiumdiacetat Al (OH) (CH3COO)to.
Det kan også opnås ved omsætning af aluminiumhydroxid Al (OH)3 og eddikesyre CH3COOH.
Anvendelser i medicin
Øreinfektioner
Aluminiumacetat er blevet brugt siden det 19. århundrede til behandling af otitis, som er en betændelse i det ydre eller mellemøret som regel ledsaget af infektion. Dens anvendelse skyldes dets antibakterielle og antifungale virkning.
Det er blevet brugt i form af en 13% aluminiumacetatopløsning, oprindeligt udtænkt af den tyske læge Karl August von Burow, hvorfor det kaldes Burows opløsning..
Det har vist sig at hæmme væksten af mikroorganismer, der almindeligvis findes i otitis media eller externa, såsom otitis media. Pseudomonas aeruginosa, det Staphylococcus aureus og Proteus mirabilis.

Der er dog dem, der rapporterer, at disse løsninger kan være skadelige for øret. Nogle dyreforsøg undersøger dets toksiske virkninger på øret, men har rapporteret modstridende resultater..
Visse forskere anbefaler ikke at bruge aluminiumacetat, når trommehinden er perforeret, da det er blevet observeret at have en inflammatorisk virkning på mellemøret.
Hudsygdomme
Burows opløsning bruges som en antiseptisk, snerpende og som en topisk løsning til behandling af alvorlige udslæt, dermatitis, betændelse, kløe, brændende og solskoldning. Virker beroligende og irriterende.
Andre anvendelser
Aluminiumtriacetat og dets derivater anvendes til mange kvalitative og kvantitative kemiske eksperimenter.
Et derivat af aluminiumtriacetat, Al (OH) (CH3COO)to også kaldet aluminiumhydroxidacetat, det bruges som en forløber for at opnå nanostrukturer af gamma-aluminiumoxid (γ-AltoELLER3).
I dette tilfælde betyder forløber, at γ-Al-nanostrukturer fremstilles af aluminiumdiacetat (opnået på en bestemt måde).toELLER3, og dette opnås ved at opvarme det til meget høje temperaturer.
Nanostrukturer er meget små partikler, der kun kan observeres gennem specielle mikroskoper såsom elektronmikroskoper. Med aluminiumacetat som en forløber er der opnået γ-Al-nanostrukturertoELLER3 svarende til blade, blomster, fibre og endda nanorør.

Udgået brug
I begyndelsen af det 20. århundrede blev aluminiumacetat brugt som konserveringsmiddel i fødevarer såsom dåse pølser.
En aluminiumacetatopløsning blev fremstillet ved blanding af aluminiumsulfat Alto(SW4)3, calciumcarbonat CaCO3, eddikesyre CH3COOH og vand HtoEller, og det blev føjet til maden.
Når denne opløsning kommer i kontakt med kødet, er aluminiumet fikseret i dets bestanddele i form af en forbindelse, der er uopløselig i kogende vand, men som opløses i mavesaft ca. 80%.
Så tidligt som i 1904 vidste man, at aluminiumsalte nedsætter fordøjelsen, både i maven og i tarmene. Derfor er det en uønsket praksis at tilføje aluminiumacetatopløsninger til konserves..

Skadelige virkninger
Da der er undersøgelser, der rapporterer, at aluminiumacetat kan være giftigt, er der udført tests, hvor laboratoriemus er injiceret med aluminiumacetat.
Resultaterne indikerer, at denne forbindelse forårsager skade på rygsøjlen hos nævnte dyr såvel som skade på kromosomerne og sædcellerne hos dyrene. Med andre ord er det genotoksisk.
Dette advarer dig om de potentielle sundhedsfarer, der kan være forårsaget af overeksponering for aluminiumacetat, og for den omhu, der skal tages, når du bruger det..
Referencer
- Mac-Kay Chace, E. (1904). Anvendelsen af basisk aluminiumacetat som konserveringsmiddel i pølser. Journal of the American Chemical Society 1904, 26, 6: 662-665. Gendannet fra pubs.acs.org.
- Hood, G.C. og Ihde, A.J. (1950). Aluminiumacetater og propionater - deres fremstilling og sammensætning. Journal of the American Chemical Society 1950, 72, 5: 2094-2095. Gendannet fra pubs.acs.org.
- Pitaro, J. et al. (2013). Ototoksicitet af aluminiumacetat / benzenethoniumchlorid Otisk opløsning i Chinchilla Animal Model. Laryngoskop, 2013; 123 (10): 2521-5. Gendannet fra ncbi.nlm.nih.gov.
- Thorp, M.A. et al. (2000). Burows opløsning til behandling af aktiv slimhinde kronisk suppurativ otitis media: bestemmelse af en effektiv fortynding. The Journal of Laryngology & Otology, juni 2000, bind 114, s. 432-436. Gendannet fra ncbi.nlm.nih.gov.
- D'Souza, Mr. P. et al. (2014). Vurdering af genotoksicitet af aluminiumacetat i knoglemarv, kønsceller fra mænd og føtale leverceller fra schweiziske albinomus. Mutationsforskning 766 (2014) 16-22. Gendannet fra ncbi.nlm.nih.gov.
- Basal, Y. et al. (2015). Virkningerne af aktuelle Burows og Castellanis løsninger på mellemørsmucosa hos rotter. J. Int Adv Otol 2015; 11 (3): 253-6. Gendannet fra advancedotology.org.
- OS. National Library of Medicine. (2019). Aluminiumacetat. Gendannet fra pubchem.ncbi.nlm.nih.gov.
- Buttaravoli, P. og Leffler, S.M. (2012). Solskoldning. Hvad skal man gøre. I mindre nødsituationer (tredje udgave). Gendannet fra sciencedirect.com.
- Thompson, E. og Kalus, A. (2017). Akutte hudreaktioner og bakterielle infektioner. Behandling. I håndbogen om rejse og tropisk medicin (femte udgave). Gendannet fra sciencedirect.com.
- Kim, T. et al. (2010). Morfologisk styrbar syntese af gamma-aluminiumoxid-nanostrukturer via en ionisk væskeassisteret hydrotermisk rute. Crystal Growth & Design, bind 10, nr. 7, 2010, s. 2928-2933. Gendannet fra pubs.acs.org.
- Rajala, J.W. et al. (2015). Core-Shell elektrospundet hul keramiske fibre af aluminiumoxid. Fibre 2015, 3, 450-462. Gendannet fra mdpi.com.

Endnu ingen kommentarer