
Salpetersyre (HNO3) struktur, egenskaber, syntese og anvendelser
Det salpetersyre Det er en uorganisk forbindelse, der består af en nitrogenoxosyre. Det betragtes som en stærk syre, skønt dens pKa (-1,4) svarer til pKa af hydroniumionen (-1,74). Fra dette tidspunkt er det måske den "svageste" af mange kendte stærke syrer..
Dets fysiske udseende består af en farveløs væske, der ved opbevaring skifter til en gullig farve på grund af dannelsen af kvælstofgasser. Dens kemiske formel er HNO3.

Det er noget ustabilt og gennemgår let nedbrydning fra udsættelse for sollys. Derudover kan den nedbrydes fuldstændigt ved opvarmning, hvilket giver anledning til nitrogendioxid, vand og ilt..
Ovenstående billede viser noget salpetersyre indeholdt i en målekolbe. Dens gule farve kan bemærkes, hvilket indikerer en delvis nedbrydning.
Det bruges til fremstilling af uorganiske og organiske nitrater såvel som i nitrosoforbindelser, der anvendes til fremstilling af gødning, sprængstoffer, mellemprodukter til farvestoffer og forskellige organiske kemiske forbindelser..
Denne syre var allerede kendt af alkymisterne i det 8. århundrede, som de kaldte "agua fortis". Den tyske kemiker Johan Rudolf Glauber (1648) designede en metode til dets fremstilling, som bestod af opvarmning af kaliumnitrat med svovlsyre.
Det fremstilles industrielt efter metoden designet af Wilhelm Oswald (1901). Metoden består generelt af den katalytiske oxidation af ammonium med den successive dannelse af nitrogenoxid og nitrogendioxid til dannelse af salpetersyre..
I atmosfæren, NEJto produceret af menneskelig aktivitet reagerer med skyvand og danner HNO3. Derefter udfældes det under syreregn sammen med vanddråber og spiser for eksempel statuer på offentlige pladser..
Salpetersyre er en meget giftig forbindelse, og kontinuerlig eksponering for dens dampe kan føre til kronisk bronkitis og kemisk lungebetændelse..
Artikelindeks
- 1 Stik af salpetersyre
- 1.1 Resonansstrukturer
- 2 Fysiske og kemiske egenskaber
- 2.1 Kemiske navne
- 2.2 Molekylvægt
- 2.3 Fysisk udseende
- 2.4 Lugt
- 2.5 Kogepunkt
- 2.6 Smeltepunkt
- 2.7 Opløselighed i vand
- 2.8 Tæthed
- 2.9 Relativ densitet
- 2.10 Relativ dampdensitet
- 2.11 Damptryk
- 2.12 Nedbrydning
- 2.13 Viskositet
- 2.14 Korrosion
- 2.15 Molær fordampning
- 2.16 Standard molær entalpi
- 2.17 Standard molær entropi
- 2.18 Overfladespænding
- 2.19 Lugttærskel
- 2.20 Dissociationskonstant
- 2.21 Brydningsindeks (η / D)
- 2.22 Kemiske reaktioner
- 3 Syntese
- 3.1 Industriel
- 3.2 I laboratoriet
- 4 anvendelser
- 4.1 Gødningsproduktion
- 4.2 Industriel
- 4.3 Metalrenser
- 4.4 Aqua regia
- 4.5 Møbler
- 4.6 Rengøring
- 4.7 Fotografi
- 4.8 Andre
- 5 Toksicitet
- 6 Referencer
Salpetersyrestruktur
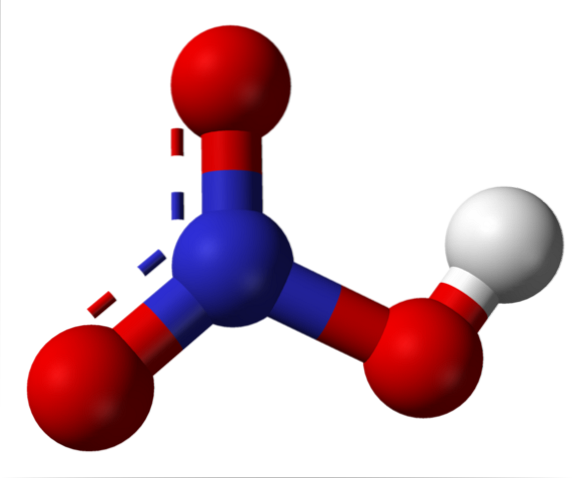
Det øverste billede viser strukturen af et HNO-molekyle.3 med en model af kugler og stænger. Nitrogenatomet, den blå kugle, er placeret i midten omgivet af en trigonal plangeometri; dog er trekanten forvrænget af en af dens længste hjørner.
Salpetersyremolekyler er derefter flade. N = O, N-O og N-OH obligationer udgør hjørnerne af den flade trekant. Hvis det observeres detaljeret, er N-OH-bindingen mere langstrakt end de to andre (hvor den hvide kugle, der repræsenterer H-atomet, findes).
Resonansstrukturer
Der er to bindinger, der har samme længde: N = O og N-O. Denne kendsgerning er i modstrid med valensbåndsteorien, hvor dobbeltbindinger forudsiges at være kortere end enkeltbindinger. Forklaringen på dette ligger i fænomenet resonans, som det ses på billedet nedenfor.

Begge obligationer, N = O og N-O, er derfor ækvivalente med hensyn til resonans. Dette er repræsenteret grafisk i strukturmodellen ved hjælp af en stiplet linje mellem to O-atomer (se struktur).
Når HNO deprotoneres3, den stabile anionnitrat NO dannes3-. I den involverer resonansen nu alle tre O-atomer. Dette er grunden til HNO3 har høj Bronsted-Lowry-surhed (H-ion-donorarter+).
Fysiske og kemiske egenskaber
Kemiske navne
-Salpetersyre
-Azotisk syre
-Hydrogennitrat
-Fortis vand.
Molekylær vægt
63,012 g / mol.
Fysisk fremtoning
Farveløs eller lysegul væske, der kan blive rødbrun.
Lugt
Skarp, kvælende egenskab.
Kogepunkt
181ºF til 760mmHg (83ºC).
Smeltepunkt
-41,6 ºC.
Vandopløselighed
Meget opløselig og blandbar med vand.
Massefylde
1,513 g / cm3 ved 20 ºC.
Relativ tæthed
1,50 (i forhold til vand = 1).
Relativ damptæthed
2 eller 3 gange estimeret (i forhold til luft = 1).
Damptryk
63,1 mmHg ved 25 ºC.
Nedbrydning
Ved udsættelse for atmosfærisk fugt eller varme kan den nedbrydes til dannelse af nitrogenperoxid. Når det opvarmes til nedbrydning, udsender det en meget giftig røg af nitrogenoxid og hydrogennitrat..
Salpetersyre er ikke stabil, den kan nedbrydes ved kontakt med varme og udsættelse for sollys og udsender nitrogendioxid, ilt og vand..
Viskositet
1.092 mPa ved 0 ° C og 0,617 mPa ved 40 ° C.
Korrosion
Det er i stand til at angribe alle uædle metaller undtagen aluminium og kromstål. Angriber nogle af sorterne af plast, gummi og belægning. Det er et ætsende og ætsende stof, så det skal håndteres med ekstrem forsigtighed.
Molær fordampning
39,1 kJ / mol ved 25 ºC.
Standard molær entalpi
-207 kJ / mol (298 ºF).
Standard molær entropi
146 kJ / mol (298 ºF).
Overfladespænding
-0,04356 N / m ved 0 ºC
-0,04115 N / m ved 20 ºC
-0,0376 N / m ved 40 ºC
Lugtgrænse
-Lav lugt: 0,75 mg / m3
-Høj lugt: 250 mg / m3
-Irriterende koncentration: 155 mg / m3.
Dissociation konstant
pKa = -1,38.
Brydningsindeks (η / D)
1.393 (16,5 ºC).
Kemiske reaktioner
Hydrering
-Kan danne faste hydrater, såsom HNO3∙ HtoO og HNO3∙ 3HtoEller: "salpetersyre".
Dissociation i vand
Salpetersyre er en stærk syre, der ioniserer hurtigt i vand som følger:
HNO3 (l) + HtoO (l) => H3ELLER+ (ac) + NEJ3-
Saltdannelse
Reagerer med basiske oxider til dannelse af et nitratsalt og vand.
CaO (s) + 2 HNO3 (l) => Ca (NO3)to (ac) + HtoO (l)
På samme måde reagerer det med baser (hydroxider) og danner et salt af nitrat og vand..
NaOH (aq) + HNO3 (l) => NaNO3 (ac) + HtoO (l)
Og også med carbonater og syrekarbonater (bicarbonater), der også danner kuldioxid.
NatoCO3 (ac) + HNO3 (l) => NaNO3 (ac) + HtoO (l) + COto (g)
Protonation
Salpetersyre kan også opføre sig som en base. Af denne grund kan den reagere med svovlsyre.
HNO3 + 2HtoSW4 <=> IKKEto+ + H3ELLER+ + 2HSO4-
Autoprotolyse
Salpetersyre gennemgår autoprotolyse.
2HNO3 <=> IKKEto+ + IKKE3- + HtoELLER
Metaloxidation
I reaktionen med metaller opfører salpetersyre sig ikke som stærke syrer, der reagerer med metaller, danner det tilsvarende salt og frigiver brint i gasform..
Imidlertid reagerer magnesium og mangan varmt med salpetersyre, ligesom de andre stærke syrer gør..
Mg (s) + 2 HNO3 (l) => Mg (NO3)to (ac) + Hto (g)
Andet
Salpetersyre reagerer med metalsulfitter til dannelse af et nitratsalt, svovldioxid og vand..
NatoSW3 (s) + 2 HNO3 (l) => 2 NaNO3 (ac) + SOto (g) + HtoO (l)
Og det reagerer også med organiske forbindelser, der erstatter et hydrogen med en nitrogruppe; udgør således grundlaget for syntesen af eksplosive forbindelser såsom nitroglycerin og trinitrotoluen (TNT).
Syntese
Industriel
Det produceres på industrielt niveau gennem katalytisk oxidation af ammonium ifølge metoden beskrevet af Oswald i 1901. Proceduren består af tre trin eller trin.
Trin 1: Oxidation af ammonium til nitrogenoxid
Ammoniak oxideres af ilt i luften. Reaktionen udføres ved 800 ° C og ved et tryk på 6-7 atm under anvendelse af platin som katalysator. Ammoniak blandes med luft med følgende forhold: 1 volumen ammoniak pr. 8 volumener luft.
4NH3 (g) + 5Oto (g) => 4NO (g) + 6HtoO (l)
Nitrogenoxid produceres i reaktionen, som føres til oxidationskammeret til næste trin..
Trin 2. Oxidation af nitrogenoxid til nitrogendioxid
Oxidationen udføres af det ilt, der er til stede i luften, ved en temperatur under 100 ºC.
2NO (g) + Oto (g) => 2NOto (g)
Trin 3. Opløsning af nitrogendioxid i vand
I dette trin opstår dannelsen af salpetersyre.
4NOto + 2HtoO + Oto => 4HNO3
Der er flere metoder til absorption af nitrogendioxid (NOto) i vand.
Blandt andre metoder: NEJto er dimeriseret til NtoELLER4 ved lave temperaturer og højt tryk for at øge dets opløselighed i vand og producere salpetersyre.
3NtoELLER4 + 2HtoO => 4HNO3 + 2NO
Salpetersyren produceret ved oxidation af ammoniak har en koncentration mellem 50-70%, som kan bringes til 98% ved anvendelse af koncentreret svovlsyre som et dehydratiseringsmiddel, hvilket gør det muligt at øge koncentrationen af salpetersyre..
På laboratoriet
Termisk nedbrydning af kobber (II) nitrat, der producerer nitrogendioxid og iltgasser, der ledes gennem vand til dannelse af salpetersyre; som i Oswald-metoden, der tidligere er beskrevet.
2Cu (NO3)to => 2CuO + 4NOto + ELLERto
Reaktion af et nitratsalt med HtoSW4 koncentreret. Den dannede salpetersyre er adskilt fra HtoSW4 ved destillation ved 83 ºC (salpetersyres kogepunkt).
KNO3 + HtoSW4 => HNO3 + KHSO4
Ansøgninger
Gødningsproduktion
60% af salpetersyreproduktionen anvendes til fremstilling af gødning, især ammoniumnitrat.
Dette er kendetegnet ved sin høje koncentration af kvælstof, et af de tre vigtigste plante næringsstoffer, nitrat bruges straks af planterne. I mellemtiden oxideres ammoniak af mikroorganismerne i jorden og bruges som en langvarig gødning..
Industriel
-15% af salpetersyreproduktionen anvendes til fremstilling af syntetiske fibre.
-Det bruges til produktion af salpetersyreestere og nitroderivater; såsom nitrocellulose, akrylmaling, nitrobenzen, nitrotoluen, acrylonitriler osv..
-Det kan tilføje nitrogrupper til organiske forbindelser, og denne egenskab kan bruges til at fremstille sprængstoffer såsom nitroglycerin og trinitrotoluen (TNT)..
-Adipinsyre, en forløber for nylon, produceres i stor skala ved oxidation af cyclohexanon og cyclohexanol med salpetersyre..
Metalrenser
Salpetersyre er på grund af dets oxidationsevne meget nyttig til oprensning af metaller til stede i mineraler. Ligeledes anvendes det til opnåelse af grundstoffer såsom uran, mangan, niob, zirconium og ved forsuring af fosforsyre til opnåelse af fosforsyre..
Royal vand
Det blandes med koncentreret saltsyre til dannelse af "aqua regia". Denne opløsning er i stand til at opløse guld og platin, hvilket muliggør dets anvendelse til oprensning af disse metaller..
Møbel
Salpetersyre bruges til at opnå en antik effekt i møbler lavet med fyrretræ. Behandling med en 10% salpetersyreopløsning giver en grå-guldfarve i møblets træ.
Rengøring
-Blandingen af vandige opløsninger af salpetersyre 5-30% og phosphorsyre 15-40% anvendes til rengøring af det udstyr, der anvendes til malkearbejdet, for at eliminere resterne af bundfaldene af magnesium og calciumforbindelser.
-Det er nyttigt til rengøring af glasvarer, der bruges i laboratoriet.
Fotografering
-Salpetersyre er blevet brugt til fotografering, specifikt som et additiv til jernholdige sulfatudviklere i den våde pladeproces for at fremme en hvidere farve i ambrotyper og farvetyper..
-Det blev brugt til at sænke pH-værdien i sølvbadet på collodionpladerne, hvilket gjorde det muligt at opnå en reduktion i udseendet af en tåge, der interfererede med billederne.
Andre
-På grund af dets opløsningsmiddelkapacitet bruges det til analyse af forskellige metaller ved hjælp af flammeatomabsorptionsspektrofotometri-teknikker og induktivt koblet plasmamassespektrofotometri..
-Kombinationen af salpetersyre og svovlsyre blev brugt til omdannelse af almindelig bomuld til cellulosenitrat (salpeterbomuld).
-Lægemidlet Salcoderm til ekstern brug anvendes til behandling af godartede neoplasmer i huden (vorter, majs, kondylomer og papillomer). Det besidder egenskaber ved kauterisering, lindring af smerte, irritation og kløe. Salpetersyre er hovedkomponenten i lægemiddelformlen.
-Rød rygende salpetersyre og hvid røgende salpetersyre bruges som oxidanter til flydende raketbrændstoffer, især i BOMARC-missilet..
Toksicitet
-I kontakt med huden kan det forårsage forbrændinger af huden, svær smerte og dermatitis..
-I kontakt med øjnene kan det forårsage svær smerte, rive og i alvorlige tilfælde hornhindebeskadigelse og blindhed..
-Indånding af dampene kan forårsage hoste, åndedrætsbesvær, forårsage næseblod, laryngitis, kronisk bronkitis, lungebetændelse og lungeødem ved svær eller kronisk eksponering..
-På grund af dets indtagelse er der læsioner i munden, spyt, intens tørst, smerte at synke, intens smerte i hele fordøjelseskanalen og risiko for perforering af væggen i den samme..
Referencer
- Wikipedia. (2018). Salpetersyre. Gendannet fra: en.wikipedia.org
- PubChem. (2018). Salpetersyre. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Redaktørerne af Encyclopaedia Britannica. (23. november 2018). Salpetersyre. Encyclopædia Britannica. Gendannet fra: britannica.com
- Shrestha B. (s.f.). Egenskaber ved salpetersyre og anvendelser. Chem Guide: tutorials til kemilæring. Gendannet fra: chem-guide.blogspot.com
- Kemikaliebog. (2017). Salpetersyre. Gendannet fra: chemicalbook.com
- Imanol. (10. september 2013). Salpetersyreproduktion. Gendannet fra: ingenieriaquimica.net



Endnu ingen kommentarer