
Elektronisk affinitetsvariation i periodisk system og eksempler
Det Elektronisk tilknytning eller elektroaffinitet er et mål for den energiske variation af et atom i gasfasen, når det inkorporerer en elektron i dets valensskal. Når elektronen er erhvervet af atom A, resulterer den resulterende anion A- det kan eller ikke være mere stabilt end din baseline-tilstand. Derfor kan denne reaktion være endoterm eller eksoterm..
Efter konvention tildeles elektronaffinitetsværdien, når elektronforstærkningen er endoterm, et positivt tegn "+"; På den anden side, hvis den er eksoterm - det vil sige, frigiver den energi - denne værdi får et negativt tegn "-". I hvilke enheder udtrykkes disse værdier? I kJ / mol eller i eV / atom.
Hvis elementet var i en flydende eller fast fase, ville dets atomer interagere med hinanden. Dette ville få den absorberede eller frigivne energi på grund af den elektroniske forstærkning til at blive spredt blandt alle disse og give upålidelige resultater..
På den anden side antages de i gasfasen at være isolerede; med andre ord interagerer de ikke med noget. Så atomerne involveret i denne reaktion er: A (g) og A.-(g). Her angiver (g), at atomet er i gasfasen.
Artikelindeks
- 1 Første og anden elektroniske tilhørighed
- 1.1 Først
- 1.2 Andet
- 2 Hvordan elektronaffinitet varierer i det periodiske system
- 2.1 Variation med kernen og afskærmningseffekten
- 2.2 Variation efter elektronkonfiguration
- 3 eksempler
- 3.1 Eksempel 1
- 3.2 Eksempel 2
- 4 Referencer
Første og anden elektroniske tilhørighed
Først
Den elektroniske forstærkningsreaktion kan repræsenteres som:
A (g) + e- => A-(g) + E eller som A (g) + e- + E => A-(g)
I den første ligning findes E (energi) som et produkt på venstre side af pilen; og i den anden ligning tælles energien som reaktiv, idet den er placeret på højre side. Det vil sige, den første svarer til en eksoterm elektronisk forstærkning og den anden svarer til en endoterm elektronisk forstærkning.
I begge tilfælde er det imidlertid kun en elektron, der føjes til valensskallen af atom A..
Sekund
Det er også muligt, at når den negative ion A er dannet-, det absorberer en anden elektron igen:
TIL-(g) + e- => Ato-(g)
Værdierne for den anden elektronaffinitet er imidlertid positive, da de elektrostatiske frastødninger mellem den negative ion A skal overvindes- og den indgående elektron e-.
Hvad bestemmer, at et gasformigt atom bedre "modtager" en elektron? Svaret findes i det væsentlige i kernen, i afskærmningseffekten af de indre elektroniske lag og i valenslaget.
Hvordan elektronaffinitet varierer i det periodiske system
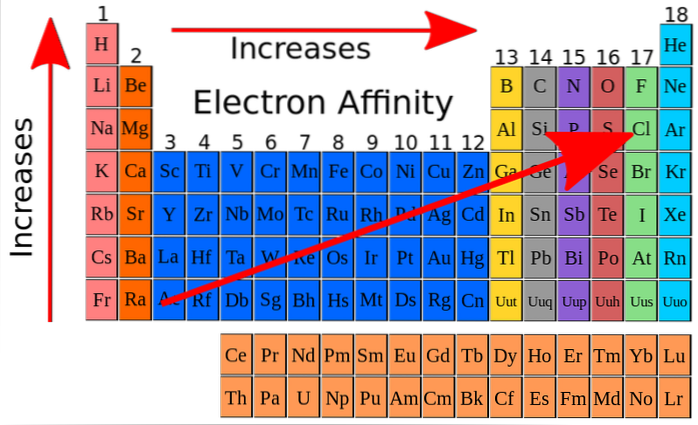
I det øverste billede angiver de røde pile retningerne, i hvilken elementernes elektroniske affinitet øges. Ud fra dette kan elektronaffinitet forstås som endnu en af de periodiske egenskaber med den ejendommelighed, at den giver mange undtagelser.
Elektronaffinitet øges stigende gennem grupperne og øges også fra venstre mod højre langs det periodiske system, især i nærheden af fluoratomet. Denne egenskab er tæt knyttet til atomradius og energiniveauerne i dens orbitaler..
Variation efter kerne og afskærmningseffekt
Kernen har protoner, som er positivt ladede partikler, der udøver en attraktiv kraft på elektronerne i atomet. Jo tættere elektronerne er på kernen, jo større tiltrækning føler de. Når afstanden fra kernen til elektronerne stiger, jo mindre er de attraktive kræfter således..
Derudover hjælper elektronerne i den indre skal med at "beskytte" kernens virkning på elektronerne i de yderste skaller: valenselektronerne..
Dette skyldes de elektroniske frastød mellem deres negative ladninger. Imidlertid modvirkes denne effekt ved at øge atomnummeret Z.
Hvordan relaterer ovenstående sig til elektronisk tilknytning? At et gasformigt atom A vil have en større tendens til at få elektroner og danne stabile negative ioner, når afskærmningseffekten er større end frastødningerne mellem den indkommende elektron og valensskallens.
Det modsatte opstår, når elektronerne er meget langt fra kernen, og frastødningerne imellem dem ikke underminerer den elektroniske forstærkning..
For eksempel åbner nye energiniveauer, der falder ned i en gruppe, hvilket øger afstanden mellem kernen og eksterne elektroner. Det er af denne grund, at de elektroniske tilhørsforhold øges, når de stiger gennem grupperne.
Variation efter elektronkonfiguration
Alle orbitaler har deres energiniveauer, så hvis den nye elektron vil indtage en orbital med højere energi, skal atomet absorbere energi for at dette er muligt..
Desuden kan den måde, hvorpå elektroner optager orbitalerne, muligvis eller måske ikke favorisere elektronisk forstærkning og således skelne forskelle mellem atomer..
For eksempel, hvis alle elektroner ikke er parret i p-orbitalerne, vil inkluderingen af en ny elektron forårsage dannelsen af et parret par, som udøver frastødende kræfter på de andre elektroner..
Dette er tilfældet for nitrogenatomet, hvis elektronaffinitet (8kJ / mol) er lavere end for carbonatomet (-122kJ / mol).
Eksempler
Eksempel 1
Den første og anden elektroniske affinitet for ilt er:
O (g) + e- => O-(g) + (141 kJ / mol)
ELLER-(g) + e- + (780 kJ / mol) => Oto-(g)
Elektronkonfigurationen for O er 1sto2sto2 s4. Der er allerede et par par elektroner, som ikke kan overvinde kernens attraktive kraft; derfor frigiver den elektroniske forstærkning energi, efter at den stabile O-ion er dannet.-.
Men selvom Oto- Det har den samme konfiguration som ædelgasneonet, dets elektroniske frastødninger overstiger kernens tiltrækkende kraft, og for at tillade indgangen til elektronen er et energibidrag nødvendigt.
Eksempel 2
Hvis de elektroniske tilhørsforhold for elementerne i gruppe 17 sammenlignes, opnås følgende:
F (g) + e- = F-(g) + (328 kJ / mol)
Cl (g) + e- = Cl-(g) + (349 kJ / mol)
Br (g) + e- = Br-(g) + (325 kJ / mol)
I (g) + e- = Jeg-(g) + (295 kJ / mol)
Fra top til bund - faldende i gruppen - stiger atomradierne såvel som afstanden mellem kernen og de eksterne elektroner. Dette medfører en stigning i elektroniske tilhørsforhold; imidlertid overgår fluor, som skulle have den højeste værdi, klor.
Hvorfor? Denne anomali viser effekten af elektroniske frastød på den attraktive kraft og lave afskærmning..
Fordi det er et meget lille atom, "kondenserer" fluor alle dets elektroner i et lille volumen, hvilket forårsager en større frastødning på det indkommende elektron i modsætning til dets mere voluminøse kongenere (Cl, Br og I)..
Referencer
- Kemi LibreTexts. Elektronaffinitet. Hentet den 4. juni 2018 fra: chem.libretexts.org
- Jim Clark. (2012). Elektronaffinitet. Hentet den 4. juni 2018 fra: chemguide.co.uk
- Carl R. Nave. Elektronaffiniteter fra hovedgruppens elementer. Hentet den 4. juni 2018 fra: hyperphysics.phy-astr.gsu.edu
- Prof. N. De Leon. Elektronaffinitet. Hentet den 4. juni 2018 fra: iun.edu
- Helmenstine, Anne Marie, Ph.D. (27. maj 2016). Definition af elektronaffinitet. Hentet den 4. juni 2018 fra: thoughtco.com
- Cdang. (3. oktober 2011). Periodisk system for elektronaffinitet. [Figur]. Hentet den 4. juni 2018 fra: commons.wikimedia.org
- Whitten, Davis, Peck & Stanley. Kemi. (8. udgave). CENGAGE Learning, s 227-229.
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave., S. 29). Mc Graw Hill.



Endnu ingen kommentarer