
LIA Agar (lysinjern) baggrund, forberedelse og anvendelser
Det LIA agar (Iron Lysine) er en biokemisk test, der anvendes til identifikation af bakterier af Enterobacteriaceae-familien. Dette medium blev oprettet af Edwards og Fife, baseret på Falkow-formlen.
Oprindeligt var denne test en bouillon indeholdende peptoner, gærekstrakt, glukose, L-lysin, bromocresollilla og destilleret vand. Edwards og Fife tilsatte agar-agar, jern-ammoniumcitrat og natriumthiosulfat..
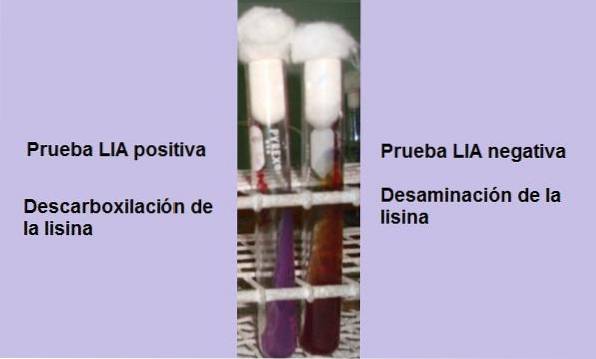
Testen består grundlæggende af at demonstrere tilstedeværelsen af enzymet lysindecarboxylase, der er i stand til at reagere med carboxylgruppen i aminosyren L-lysin. En deaminering af aminosyren kan også forekomme på grund af tilstedeværelsen af enzymet lysindeaminase..
Derudover tillader sammensætningen af mediet bevis for evnen hos nogle bakterieslægter til at producere hydrogensulfid. Endelig er det også muligt at observere dannelsen eller ej af gas i mediet.
Artikelindeks
- 1 begrundelse
- 1.1 Peptoner og gærekstrakt
- 1.2 Glukose
- 1.3 L-lysin
- 1,4 pH-indikator (bromocresol lilla)
- 1.5 Ferrinammoniumcitrat og natriumthiosulfat
- 2 Fortolkning af testen
- 2.1 Decarboxylering af lysin
- 2.2 Deaminering af lysin
- 2.3 Produktion af hydrogensulfid (H2S)
- 3 Registrering af resultater
- 4 Forberedelse
- 5 anvendelser
- 6 Referencer
Basis
Peptoner og gærekstrakt
Ligesom de fleste dyrkningsmedier indeholder lysinjernagar komponenter, der giver kilden til næringsstoffer, der er nødvendige for bakterievækst. Disse komponenter er repræsenteret af peptoner og gærekstrakt.
Glukose
Ligeledes indeholder denne agar glukose som et fermenterbart kulhydrat. Alle bakterier i Enterobacteriaceae-familien vides at fermentere glukose.
Dette trin er afgørende, fordi det vil være ansvarligt for forsuring af mediet, en væsentlig betingelse for, at enzymet lysindecarboxylase, hvis det er til stede, virker på dets substrat..
I nogle bakterieslægter kan gasproduktion observeres på grund af glukosefermentering.
Gassen fremgår, når der er en forskydning af agaren i røret, hvilket efterlader et tomt rum i bunden af røret eller ved brud på mediet i to eller flere dele.
L-lysin
Når lysin er decarboxyleret, dannes en diamin (kadaverin) og kuldioxid.
Decarboxylering finder sted i nærværelse af pyridoxalphosphat-coenzym. Denne reaktion er irreversibel.
PH indikator (bromocresol lilla)
Alle pH-ændringer, der forekommer i mediet på grund af de forskellige reaktioner, detekteres af den lilla bromocresol pH-indikator..
I denne forstand, når der er forsuring, bliver mediet gult, og når der er alkalisering, vender mediet tilbage til sin oprindelige lilla eller lilla farve..
Når deaminering af lysin opstår på grund af tilstedeværelsen af enzymet lysindeaminase, dannes en rødlig farve på overfladen, typisk i slægterne Proteus, Providencia og nogle arter af Morganella.
Dette skyldes, at der dannes alfa-keto-carbonsyre under deamineringsprocessen, som reagerer med ammoniumcitrat i nærvær af ilt og forårsager den ovennævnte farve..
Ferriammoniumcitrat og natriumthiosulfat
På den anden side vil bakterier, der producerer hydrogensulfid, påvises ved tilstedeværelsen af natriumthiosulfat (kilde til svovl) og jernholdig ammoniumcitrat, som er udvikleren af HtoS.
Bakterier, der har enzymet thiosulfatreduktase, har evnen til at virke ved at reducere det tilstedeværende natriumthiosulfat og danne sulfit og hydrogensulfid (HtoS).
Sidstnævnte er en farveløs gas, men når den reagerer med jernsaltet, danner den jernholdigt metallisk sulfid, som er en uopløselig forbindelse (synligt sort bundfald).
Imidlertid er dannelseskapaciteten af HtoS med dette medium er ikke særlig pålidelig, fordi nogle lysindecarboxylase-negative bakterier er i stand til at producere HtoS vil ikke danne det sorte bundfald, da surhedsgraden af mediet forstyrrer. Derfor anbefales det at tjekke med andre medier, der indeholder jern.
Fortolkning af testen
Lysindecarboxylering
Rørene skal læses efter 24 timers inkubation, ellers er der risiko for at fortolke reaktionen fejlagtigt og rapportere falske negativer.
Det skal huskes, at den første reaktion, der vil forekomme, vil være gæring af glukose, derfor bliver alle rørene efter 10 til 12 timer gule..
Hvis der ved slutningen af inkubationstiden (24 timer) observeres en gul baggrund med en lilla eller lilla overflade, er reaktionen negativ. Den lilla farve på overfladen svarer til alkaliseringen af mediet ved anvendelse af peptoner.
En positiv reaktion er en, hvor bunden og overfladen af røret er helt lilla, dvs. det vender tilbage til den oprindelige farve..
Derfor, hvem der bestemmer testens positivitet, er basen eller baggrunden for mediet. Hvis du er i tvivl om farven, kan den sammenlignes med et ikke-inokuleret LIA-rør.
Deaminering af lysin
Et rør, der viser lysindeaminering, vil have en rødlig rødbrun overflade og en gul (syre) baggrund, eller hele røret vil have en rødlig rødbrun farve..
Denne reaktion fortolkes som negativ for lysindecarboxylering, men positiv for lysindeaminering..
Denne reaktion er defineret og fortolket på rammen.
Produktion af hydrogensulfid (HtoS)
En positiv reaktion observeres ved fremkomsten af et sort bundfald i hele eller en del af mediet. Normalt mellem kanten af skråningen og bunden.
Hvis bundfaldet forekommer i hele røret, viser det ikke de andre reaktioner, der forekommer i midten..
Registrering af resultater
Ved fortolkning af testen registreres resultaterne som følger:
Rammen læses først, derefter bunden eller blokken, derefter produktionen af HtoJa, og endelig gasproduktion.
Eksempel: K / A + (-). Det betyder:
- K: Alkalisk ramme (lilla farve)
- A: Sur baggrund (gul), dvs. negativ decarboxyleringsreaktion og negativ deaminering.
- +: Produktion af hydrogensulfid
- (-): Uden gas.
Forberedelse
Vej 35 g af det dehydrerede jernagarlysinmedium og opløses i en liter destilleret vand..
Varm op, indtil agaren er helt opløst. Lad det koge i et minut under omrøring ofte. Fordel 4 ml af mediet i 13/100 reagensglas med bomuldshætter.
Steriliseres i en autoklav ved 121 ° C i 15 minutter. Fjern fra autoklaven, og lad den stå i en vinkel, så der er en dyb base og en kort skråning.
Opbevares i køleskab 2-8 ° C. Lad det varme op, før bakteriestammen sås.
Det dehydratiserede medium er beige og det tilberedte medium er rødlilla..
Den endelige pH i det fremstillede medium er 6,7 ± 0,2
Mediet bliver gult med pH lig med eller mindre end 5,2 og er lilla ved pH 6,5 og derover.
Ansøgninger
Denne test sammen med andre biokemiske tests bruges til at identificere baciller af Enterobacteriaceae-familien..
Mediet frøes med en lige løkke eller nål, der foretages en eller to punkteringer i bunden af røret, og derefter scannes overfladen på mediet i en zigzag..
Inkuber i 24 timer ved 35-37 ° C i aerobiose. Hvis det er nødvendigt, inkuberes i yderligere 24 timer..
Det er hovedsageligt nyttigt at skelne laktosenegative Citrobacter-arter fra Salmonellas sp.
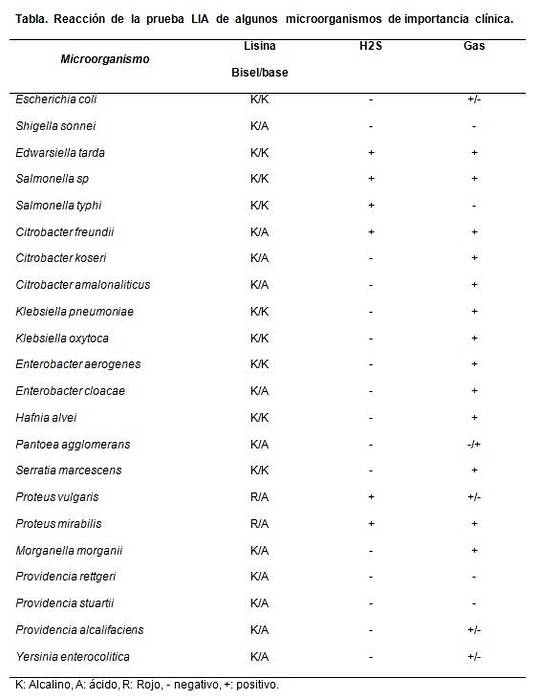
Referencer
- Mac Faddin J. (2003). Biokemiske tests til identifikation af bakterier af klinisk betydning. 3. udgave Redaktionel Panamericana. Buenos Aires. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnose. 12. udgave Redaktionel Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. 5. udgave Redaktionel Panamericana S.A. Argentina.
- Britannia Laboratories. Lysinjernagar. 2015.Tilgængelig på: britanialab.com
- BD Laboratories. BBL lysin jernagar skråninger. 2007. Fås på: bd.com
- Valtek Laboratories. Mellem L.I.A. 2009. Tilgængelig på: andinamedica.com


Endnu ingen kommentarer