
Müeller Hinton agar fundament, forberedelse og anvendelser
Det Müeller Hinton agar Det er et fast, ikke-selektivt næringsmedium, der består af kødinfusion, syre-kaseinpepton, stivelse, agar og destilleret vand. Dette medium tillader fremragende mikrobiel vækst af de fleste hurtigt voksende bakterier.
Det blev oprindeligt oprettet af John Howard Müeller og Jane Hinton for at isolere ernæringsmæssigt krævende bakterier såsom Neisseria gonorrhoeae Y Neisseria meningitidis. På grund af dets egenskaber viste det sig imidlertid at være ideel til undersøgelse af modtagelighed over for antibiotika, hvilket giver pålidelige og reproducerbare resultater..
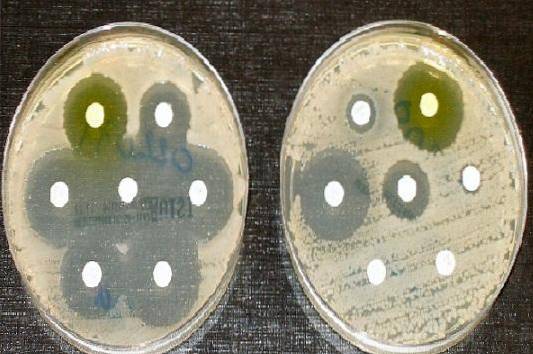
Derfor er Müeller Hinton agar det dyrkningsmedium, der accepteres af Clinical and Laboratory Standards Institute (CLSI) og Den Europæiske Komité for antimikrobiel modtagelighedstest til udførelse af den antimikrobielle modtagelighedstest ved Kirby diskdiffusionsmetode og Bauer.
Artikelindeks
- 1 begrundelse
- 2 Forberedelse
- 3 anvendelser
- 3.1 Antibiogram-teknikken
- 3.2 Strategisk placering af diske på Müeller Hinton agar
- 4 Årsager til fejlagtige resultater
- 5 Begrænsning
- 6 Kvalitetskontrol
- 7 Referencer
Basis
At være et ikke-selektivt næringsmedium er det fremragende til vækst af de fleste patogene bakterier..
På den anden side gør dens enkle sammensætning, at stofferne let diffunderer på det, hvilket er en væsentlig egenskab for følsomhedstesten ved hjælp af diskdiffusionsmetoden..
En anden af dens egenskaber er, at den indeholder en lav mængde inhibitorer, som gør det muligt at evaluere sulfonamider, trimethoprim og tetracycliner effektivt..
Det skal dog huskes, at mediet skal opfylde visse betingelser for at sikre, at det fungerer korrekt, herunder:
Justering af pH, dybden af agar og den passende koncentration af thymin, thymidin, Ca++, Mg++ og Zn++.
Du skal også vide, at metoden er standardiseret, og derfor skal alle parametre være opfyldt, såsom:
Inokulumkoncentrationen, koncentrationen og konserveringen af de antibiotiske skiver, placeringen af det passende antal skiver på agaren, afstanden mellem en skive og en anden, strategisk placering af visse antibiotika, atmosfæren, temperaturen og inkubationstidspunktet.
Forberedelse
Afvej 37 g dehydreret Müeller Hinton-medium og opløses i 1 liter destilleret vand. Varm mediet under omrøring for at hjælpe med opløsning. Kog i 1 minut.
Autoklaveres til sterilisering ved 121 ° C i 15 minutter. Ved fjernelse fra autoklaven skal kolben anbringes i et vandbad ved 50 ° C for at afkøle. Hæld 25 til 30 ml i sterile petriskåle med en diameter på 10 cm.
Pladerne skal have en gennemsnitlig tykkelse på 4 mm (ideel) og have et interval på 3-5 mm.
Hvis det ønskes at forberede blodagar ved hjælp af Müeller Hinton-agar som base, hældes 5% sterilt og defibrineret lamblod inden servering på pladerne..
Mediets endelige pH skal være mellem 7,2 og 7,4.
Invester og opbevar i køleskabet indtil brug. Lad pladen komme til stuetemperatur inden brug.
Farven på det tilberedte medium er lys beige.
Ansøgninger
Bruges til at udføre antibiogram- eller antibiotikafølsomhedstesten for de fleste hurtigt voksende ikke-krævende patogener.
Hvis agaren suppleres med blod, bruges den til at udføre antibiogram af krævende mikroorganismer såsom: Streptococcus pneumoniae, Haemophilus sp, Neisseria meningitidis, blandt andre. Det er også blevet brugt til at isolere Legionella pneumophila.
Antibiogram teknik
Før du udfører antibiogrammet, skal der fremstilles en bakteriel opløsning svarende til 1,5 x 10.8 celler.
Til dette tages 3 til 4 kolonier af den rene kultur og suspenderes i en sojabønne-trypticase-bouillon eller i Müeller Hinton-bouillon, inkuberes i 2 til 6 timer, og koncentrationen justeres med sterilt saltvand, sammenlignet med en Mac Farland-standard på 0,5 %.
Hvis de kræver mikroorganismer, kan kolonier suspenderes direkte op til koncentrationen på 0,5% Mac Farland. Derefter sås Müeller Hinton-pladen med en vatpind imprægneret med den forberedte bakterieopløsning..
For at gøre dette nedsænkes podepinden i opløsningen, og derefter fjernes den overskydende væske ved at presse mod væggene i røret. Umiddelbart derefter føres vatpinden over hele overfladen og efterlader ingen steder uberørt, så drejes pladen let, og den frøes igen. Operationen gentages 2 gange til.
Lad stå i 10 minutter, og fastgør derefter antibiotikaskiverne med en steril pincet, så der er 24 mm mellemrum mellem dem. Efter at have placeret hver disk på agaren, skal du trykke let på hver disk med pincet for at sikre, at de overholdes godt..
Når processen er færdig, inverteres pladen og inkuberes ved 35-37 ° C i aerobiose i 16 til 18 timer. Hvis det er en krævende mikroorganisme, kan det berettige mikroaerofili, og hvis antibiogrammet indeholder oxacillindiske, skal det læses efter 24 timer..
En linjal bruges til at måle diameteren af hver glorie. Resultaterne skal registreres i mm. Derefter korreleres de opnåede værdier med skærepunkttabellerne, der er offentliggjort i den aktuelle CLSI-manual..

Rapporter som følsom (S), mellemliggende (I) eller resistent (R), alt efter omstændighederne.
Antibiotika vælges i henhold til den isolerede mikroorganisme og den type infektion, der forårsager.
Undertiden skal den strategiske placering af antibiotika tages i betragtning for at vise fænotypiske resistensmønstre.
Strategisk placering af diske på Müeller Hinton agar
For enterobakterier skal clavulansyreskiven placeres mod 3. og 4. generation af cephalosporiner. En ægformet udvidelse indikerer, at stammen er en producent af beta-lactamaser (ESBL) med udvidet spektrum. Dette betyder, at patienten ikke bør behandles med nogen cephalosporiner..
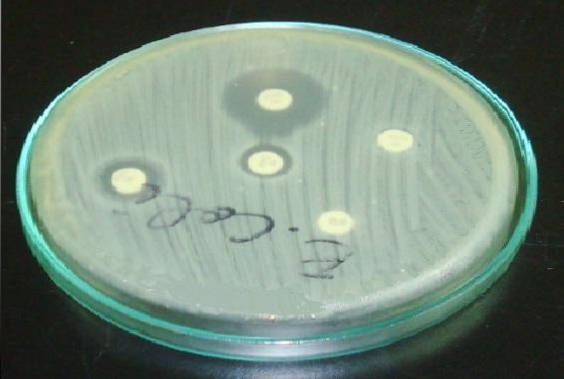
I Staphylococcus er det vigtigt at placere erythromycin eller azithromycin-skiven foran clindamycin-skiven (D-test).
En resistent halo i erythromycin og en udfladning i clindamycinhalogen indikerer, at stammen har stammeinducerbar clindamycinresistens (ICR). Dette betyder, at en behandling med clindamycin ikke vil være effektiv..
For at søge efter inducerbare AMP C-stammer i Enterobacteriaceae og nogle ikke-fermenterende Gram-negative stænger står ceftazidime, cefoxitin eller piperacillin tazobactan-skiver mod en imipenem-skive i en afstand på 27 mm.
En flad halo i en af de skiver, der vender mod imipenem, indikerer tilstedeværelsen af inducerbar AMP C.
Til søgning efter konstitutiv C-AMP står en 500 µg cloxacillin-skive over for ceftazidim (30 µg) og med cefotaxim (30 µg) i en afstand på 25 mm. En udvidet halo i et hvilket som helst af cephalosporinerne indikerer positivitet.
Cloxacillin-skiven kan også erstattes af en 9 mm skive Whatman nr. 6 filterpapir imprægneret med phenylborsyre (400 µg) med en afstand på 18 mm. Det fortolkes det samme som det foregående.
Endelig at undersøge produktionen af metallobetalactamaser især i Pseudomonas aeruginosa, En skive imprægneret med 10 µl ethylendiamintetraeddikesyre (EDTA 750 µg) og thioglycolsyre (SMA 300 µg) anvendes, der vender mod imipenem- og meropenem-skiverne i en afstand på 15 mm.
Testen er positiv, hvis der er en udvidelse af imipenem- eller meropenem-haloerne mod EDTA / SMA-disken. Dette resultat skal bekræftes med den modificerede Hodge-test..
Denne metode består i at inokulere en stamme af Escherichia coli ATCC 25922 på Müeller Hinton-pladen. En disk af imipenem placeres i midten af pladen, og derefter laves en stribe fra disken mod periferien med stammen af P. aeruginosa mistænksom. Op til 4 stammer kan testes pr. Plade.
Testen vil være positiv, hvis der er en zone med forvrængning af imipenem-glorie omkring strækmærket.
Årsager til fejlagtige resultater
-Dårligt konserverede antibiotikaskiver kan producere falsk resistens. For eksempel er oxacillindisken meget sårbar over for ændringer i temperaturen..
-En pH-værdi af mediet under den angivne (sure) producerer mindre haloer i aminoglycosider og makrolider (risiko for falsk resistens) og større haloer i penicillin, tetracyclin og novobiocin (risiko for falsk følsomhed).
-Hvis pH-værdien er over den angivne (alkaliske) vendes de ovenfor beskrevne virkninger.
-Medier med forhøjede thymin- og thymidinkoncentrationer har indflydelse ved signifikant at reducere inhiberingshaloerne af sulfonamider og trimethoprim..
-Høje koncentrationer af calcium og magnesium producerer falsk resistens mellem aminoglycosider, polymyxin B og tetracycliner mod stammer af Pseudomonas aeruginosa.
-Lave koncentrationer af calcium og magnesium frembringer falske følsomheder for aminoglycosider, polymyxin B og tetracycliner over for stammer af Pseudomonas aeruginosa.
-Tilstedeværelsen af zink påvirker resultaterne af carbapenemskiver (imipenem, meropenem og ertapenem).
-Medietykkelse under 3 mm giver falske følsomhedsresultater, mens tykkelse over 5 giver falsk modstand.
-Mobilisering af skiver i antibiogrammet vil give deformerede glorier, da udledning af antibiotika er øjeblikkelig.
- Meget svage podestoffer påvirker resultaterne, da der ikke vil være en ensartet eller sammenflydende vækst i agaren, en nødvendig betingelse for at kunne måle inhiberingshaloer ud over det faktum, at haloerne kan give større end normalt.
-Overbelastede podestoffer kan give mindre end normale haloer.
-Ved ikke at respektere afstanden mellem diske får en glorie til at overlappe hinanden, og de kan ikke læses korrekt.
-Inkuber med COto øger størrelsen på haloerne af tetracyclin- og methicillin-skiverne.
-Inkuber ved temperaturer under 35 ° C producerer større glorier.
-Tilsætningen af blod mindsker størrelsen af sulfonamidhalogen.
Begrænsning
Følsomheden af et antibiotikum, der er demonstreret i antibiogrammet mod en mikroorganisme (in vitro) er ingen garanti for, at det fungerer in vivo.
QA
For at vide, om mediet indeholder den tilstrækkelige mængde thymin, skal der dyrkes en stamme Enterococcus faecalis ATCC 29212 og test følsomheden over for trimethoprim sulfamethoxazol (SXT), skal den give en halo lig med eller> 20 mm for at være tilfredsstillende.
Referencer
- "Müller-Hinton agar." Wikipedia, The Free Encyclopedia. 16. nov 2018, 12:23 UTC. 27. januar 2019, 04:22
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnose. 12. udgave Redaktionel Panamericana S.A. Argentina.
- Cona E. Betingelser for en god følsomhedsundersøgelse ved agar-diffusionstest. Rev Chil Infect, 2002; 19 (2): 77-81
- Difco Francisco Soria Melguizo Laboratory. Müeller Hinton agar med 5% fårblod. 2009. Tilgængelig på: http://f-soria.es
- BD Müeller Hinton II Agar-laboratorium. 2017. Tilgængelig på: .bd.com
- Britannia Laboratories. Müeller Hinton agar. 2015.Tilgængelig på: britanialab.com
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. 5. udgave Redaktionel Panamericana S.A. Argentina.
- Martínez-Rojas D.AmpC-betalactamases: Generelt og metoder til fænotypisk påvisning. Præst Soc. Ven. Mikrobiol. 2009; 29 (2): 78-83. Tilgængelig på: scielo.org.
- Perozo A, Castellano M, Ling E, Arraiz N. Fænotypisk påvisning af metallobetalactamaser i kliniske isolater af Pseudomonas aeruginosa. Kasmera, 2012; 40 (2): 113-121. Tilgængelig på: scielo.org.



Endnu ingen kommentarer