
Isoamylalkoholstruktur, egenskaber, anvendelser og risici
Det isoamylalkohol er en organisk forbindelse, hvis formel er (CH3)toCHCHtoCHtoOH. Kemisk set er det en forgrenet primær alkohol og udgør en af isomererne af pentanol, kaldet amylalkoholer5H12ELLER).
Som mange alkoholer med lav molekylvægt er det en farveløs væske ved stuetemperatur. Dette tillader og letter dets anvendelse som opløsningsmiddel til forskellige applikationer; endnu mere, når det ikke udøver for mange negative virkninger på økosystemet efter bortskaffelse.
Selvom det er et mellemliggende materiale i syntesen af amylacetat til fremstilling af kunstige banan-dufte, er dens egen lugt ubehagelig og ligner den af pærer..
Ud over at tjene som opløsningsmiddel til flere biologiske stoffer og som et mellemprodukt i syntesen af andre acetater reducerer det overfladespændingen af visse industrielle formuleringer og forhindrer dannelsen af skum. Derfor bruges det i mikroemulgerede systemer.
Med hensyn til dets naturlige oprindelse er der fundet isoamylalkohol i feromoner fra horneter og i sorte trøfler, en type svampe, der ligger i det sydøstlige Europa..
Artikelindeks
- 1 Struktur af isoamylalkohol
- 1.1 Intermolekylære interaktioner
- 2 egenskaber
- 2.1 Fysisk udseende
- 2.2 Lugt og smag
- 2.3 Molær masse
- 2.4 Tæthed
- 2.5 Dampmassefylde
- 2.6 Damptryk
- 2.7 Kogepunkt
- 2.8 Smeltepunkt
- 2.9 Flammepunkt
- 2.10 Selvantændelsestemperatur
- 2.11 Opløselighed
- 2.12 Viskositet
- 2.13 Overfladespænding
- 2.14 Brydningsindeks
- 2.15 Varmekapacitet
- 3 anvendelser
- 3.1 Råmateriale
- 3.2 Dufte
- 3.3 Defoamer
- 3.4 Ekstraktioner
- 4 risici
- 4.1 Opbevaring og reaktivitet
- 4.2 Sundhed
- 5 Referencer
Struktur af isoamylalkohol
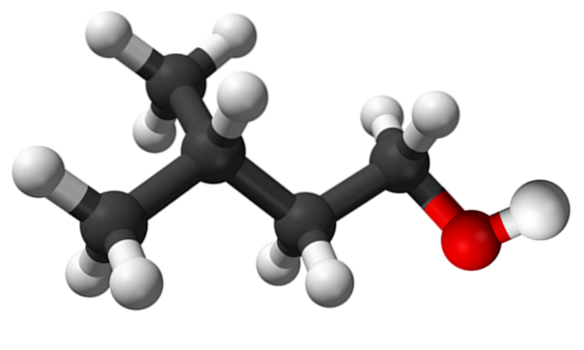
Det øverste billede viser isoamylalkoholmolekylet repræsenteret med en kugle- og søjlemodel. Til højre for det svarer den rødlige kugle til oxygengruppen i OH-gruppen, der er karakteristisk for alle alkoholer; mens til venstre er kulstofskelettet med en methylgruppe, CH3, forgreningsstruktur.
Fra et molekylært synspunkt er denne forbindelse dynamisk, fordi den har atomer med SP-hybridiseringer3, lette rotation af dine links så længe det ikke får OH og CH til at formørke3.
Det er også værd at nævne dets amfifile egenskab: den har en apolar eller hydrofob ende, der består af kæden (CH3)toCHCHtoCHto-, og et polært eller hydrofilt hoved, OH-gruppen. Denne definition af to specifikke områder med forskellige polariteter gør denne alkohol til et overfladeaktivt middel; og dermed dets anvendelse til mikroemulsioner.
Intermolekylære interaktioner
Givet tilstedeværelsen af OH-gruppen udviser isoamylalkoholmolekylet et permanent dipolmoment. Derfor formår dipol-dipolkræfterne at binde deres molekyler, der er ansvarlige for væskens fysiske og målbare egenskaber såvel som dens lugt..
Selv om forgreningen af hovedkæderne mindsker de effektive interaktioner mellem molekylerne, kompenserer hydrogenbindingerne i denne alkohol for dette fald, hvilket får væsken til at koge ved 131 ° C, en temperatur over kogepunktet for vand..
Ikke det samme sker med dets faste eller "is", der smelter ved -117 ° C, hvilket indikerer, at dets intermolekylære interaktioner ikke er stærke nok til at holde dets molekyler i orden; især hvis CH-gruppen3 som forgrener hovedkæden forhindrer bedre kontakt mellem molekylerne.
Ejendomme
Fysisk fremtoning
Farveløs væske.
Lugt og smag
Afgiver en ubehagelig pærelignende lugt og har en skarp smag.
Molar masse
88,148 g / mol.
Massefylde
0,8104 g / ml ved 20 ° C Det er derfor mindre tæt end vand.
Dampmassefylde
Det er 3,04 gange tættere end luft.
Damptryk
2,37 mmHg ved 25 ° C.
Kogepunkt
131,1 ° C.
Smeltepunkt
-117,2 ° C.
antændelsespunkt
43 ° C (lukket kop).
Selvantændelsestemperatur
340 ° C.
Opløselighed
Det er relativt opløseligt i vand: 28 g / L. Dette skyldes, at de meget polære molekyler i vand ikke har en særlig affinitet for carbonkæden af isoamylalkohol. Hvis de blev blandet, blev der observeret to faser: en lavere, svarende til vand og en højere, den for isoamylalkohol..
I modsætning hertil er det meget mere opløseligt i mindre polære opløsningsmidler, såsom: acetone, diethylether, chloroform, ethanol eller iseddikesyre; og endda i petroleumsether.
Viskositet
3.738 cP ved 25 ° C.
Overfladespænding
24,77 dyn / cm ved 15 ° C.
Brydningsindeks
1,4075 ved 20 ° C.
Varmekapacitet
2.382 kJ / gK.
Ansøgninger
Råmateriale
Andre estere, thiophen og lægemidler såsom amylnitrit, Validol (menthylisovalerat), Bromisoval (bromovalerylurea), Corvalol (en valerian beroligende middel) og Barbamil (amobarbital) kan syntetiseres fra isoamylalkohol..
Dufte
Ud over at blive brugt til syntese af amylacetat, som har en bananaroma, fås der også andre frugtduftstoffer såsom abrikos, appelsiner, blomme, kirsebær og malt. Derfor er det en nødvendig alkohol i produktionen af mange spiselige eller kosmetiske produkter..
Defoamer
Ved at reducere overfladespændingen fremmer det brugen i mikroemulgerede systemer. I praksis undgår den den accelererede dannelse af bobler og reducerer dem i størrelse, indtil de går i stykker.
Det hjælper også med bedre at definere grænsefladen mellem de vandige og organiske faser under ekstraktioner; fx tilsættes phenol-chloroform til ekstraktionsblandingen i et forhold på 25: 24: 1. Denne teknik er beregnet til DNA-ekstraktion.
Ekstraktioner
Isoamylalkohol gør det også muligt at udvinde fedt eller olier fra forskellige prøver, fx fra mælk. Ligeledes opløser det paraffinvoks, blæk, tandkød, lak og celluloseestere.
Fortsat med ekstraktionerne er det muligt at opnå phosphorsyre fra nitratopløsninger af jernphosphatmineraler..
Risici
Opbevaring og reaktivitet
Som enhver væske, der afgiver lugt, kan den repræsentere en overhængende brandrisiko, hvis det sted, hvor den opbevares, hæver temperaturen for højt, endnu mere, hvis der allerede er en varmekilde.
Under disse forhold fungerer det simpelthen som et brændstof, der brænder flammerne og endda eksploderer dens container. Ved forbrænding frigiver det dampe, der kan påvirke helbredet og forårsage kvælning.
Andre årsager til, at isoamylalkohol går i brand, er at blande det eller få det til at reagere med stoffer som: perchlorater, peroxider, brom, fluor, metalhydrider, stærke syrer, alifatiske aminer osv..
Sundhed
I kontakt med huden kan det irritere og tørre det ud. Symptomerne er dog mere alvorlige ved indånding for længe (hoste, forbrændinger i næse, hals og lunger) eller ved indtagelse (hovedpine, kvalme, diarré, opkastning, svimmelhed og bevidstløshed).
Og endelig, når det spildes i øjnene, irriterer det dem og kan endda uopretteligt skade dem. Heldigvis tillader dens "alkoholiske pære" lugt, at den detekteres i tilfælde af lækage eller spild; ud over dette er det en forbindelse, der skal håndteres med respekt.
Referencer
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kemi. 5. udgave. Redaktionel Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10. udgave.). Wiley plus.
- Wikipedia. (2019). Isoamylalkohol. Gendannet fra: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Isoamylalkohol. PubChem-database. CID = 31260. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Zhang Yu og Muhammed Mamoun. (17. september 2008). Ekstraktion af fosforsyre fra nitratopløsninger med isoamylalkohol. Solvent Extraction and Ion Exchange Volume 6, 1988 - Issue 6. doi.org/10.1080/07366298808917973
- New Jersey Department of Health. (2008). Isoamylalkohol. [PDF]. Gendannet fra: nj.gov
- Kat Chem. (2019). Isoamylalkohol. Gendannet fra: kat-chem.hu
- Chemoxy International Ltd. (s.f.). Isoamylalkohol. Gendannet fra: chemoxy.com
Endnu ingen kommentarer