
Sekundær alkoholstruktur, egenskaber, nomenklatur, anvendelser
EN sekundær alkohol Det har bærercarbon fra hydroxylgruppen (OH), der er bundet til to carbonatomer. Mens det primære alkohol er det carbon, der bærer hydroxylgruppen, bundet til et carbonatom, og i tertiær alkohol er det bundet til tre carbonatomer..
Alkoholer er lidt svagere syrer end vand med følgende pKa: vand (15,7); methyl (15,2), ethyl (16), isopropyl (sekundær alkohol, 17) og tert-butyl (18) alkoholer. Som det kan ses, er isopropylalkohol mindre sur end methyl- og ethylalkoholer..
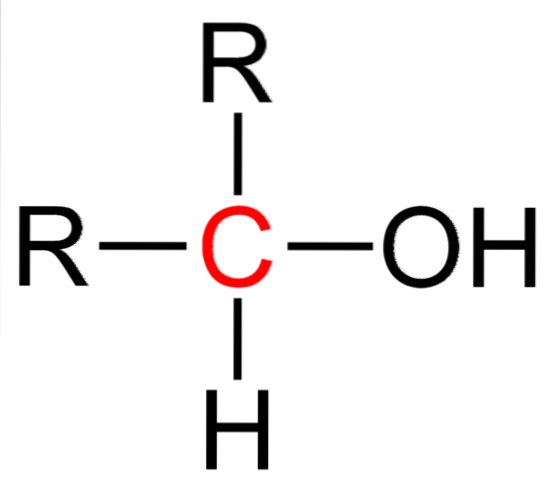
Det øverste billede viser strukturformlen for en sekundær alkohol. Carbon i rødt er bæreren af OH og er bundet til to alkyl (eller aryl) grupper R og et enkelt hydrogenatom.
Alle alkoholer har den generiske formel ROH; men hvis bærercarbonet observeres detaljeret, så er de primære alkoholer (RCHtoOH), sekundær (RtoCHOH, her rejst) og tertiær (R3COH). Denne kendsgerning gør en forskel i dens fysiske egenskaber og reaktivitet..
Artikelindeks
- 1 Struktur af en sekundær alkohol
- 2 egenskaber
- 2.1 Kogepunkter
- 2.2 Surhed
- 2.3 Reaktioner
- 3 Nomenklatur
- 4 anvendelser
- 5 eksempler
- 5.1 2-oktanol
- 5.2 Estradiol eller 17β-Estradiol
- 5.3 20-Hydroxy-leukotrien
- 5.4 2-Heptanol
- 6 Referencer
Struktur af en sekundær alkohol
Alkoholernes strukturer afhænger af arten af R-grupperne, men for sekundære alkoholer kan der foretages nogle eksempler, idet man kun kan overveje, at der kun kan være lineære strukturer med eller uden grene eller cykliske strukturer. For eksempel har du følgende billede:
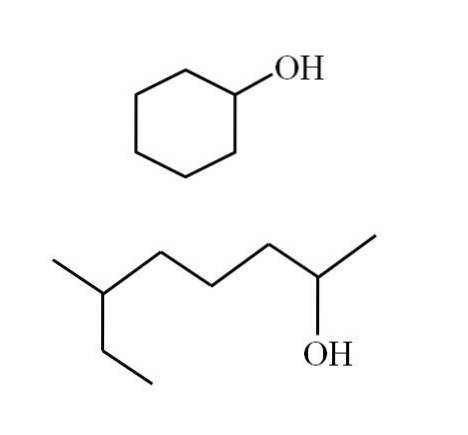
Bemærk, at der for begge strukturer er noget til fælles: OH er knyttet til et "V". Hver ende af V repræsenterer en lige R-gruppe (øverste del af billedet, cyklisk struktur) eller forskellig (nederste del, forgrenet kæde).
På denne måde identificeres enhver sekundær alkohol meget let, selvom dens nomenklatur overhovedet ikke er kendt..
Ejendomme
Kogepunkter
Egenskaberne ved sekundære alkoholer adskiller sig fysisk ikke for meget fra andre alkoholer. De er normalt transparente væsker, og for at være et fast stof ved stuetemperatur skal det danne flere hydrogenbindinger og have en høj molekylvægt.
Den samme strukturformel RtoCHOH antyder visse egenskaber, der generelt er unikke for disse alkoholer. F.eks. Er OH-gruppen mindre eksponeret og tilgængelig for hydrogenbindingsinteraktioner, RtoCH-OH-OHCHRto.
Dette skyldes, at R-grupperne, der støder op til det OH-bærende kulstof, kan komme i vejen og forhindre dannelsen af hydrogenbindinger. Som et resultat har sekundære alkoholer lavere kogepunkter end primære alkoholer (RCHtoOH).
Surhed
Ifølge Brönsted-Lowry-definitionen er en syre en, der donerer protoner eller hydrogenioner, H+. Når dette sker med en sekundær alkohol, har du:
RtoCHOH + B- => RtoCHO- + HB
Den konjugerede base RtoCHO-, alkoxidanion, skal stabilisere sin negative ladning. For den sekundære alkohol er stabiliseringen lavere, da de to R-grupper har elektronisk densitet, som til en vis grad afviser den negative ladning på iltatomet..
I mellemtiden for alkoxidanionen af en primær alkohol, RCHtoELLER-, der er mindre elektronisk frastødning, da der kun er en R-gruppe og ikke to. Derudover udøver hydrogenatomer ikke en signifikant frastødning, og tværtimod bidrager de til at stabilisere den negative ladning..
Derfor er sekundære alkoholer mindre sure end primære alkoholer. Hvis dette er tilfældet, er de mere grundlæggende og af nøjagtigt de samme grunde:
RtoCHOH + HtoB+ => RtoCHOHto+ + HB
Nu stabiliserer R-grupperne den positive ladning på ilt ved at opgive en del af dets elektrontæthed..
Reaktioner
Hydrogenhalogenid og phosphortrihalogenid
En sekundær alkohol kan reagere med et hydrogenhalogenid. Den kemiske ligning af reaktionen mellem isopropylalkohol og brombrintesyre i et svovlsyre-medium og frembringelse af isopropylbromid er vist:
CH3CHOHCH3 + HBr => CH3CHBrCH3 + HtoELLER
Og det kan også reagere med et fosfor trihalogen, PX3 (X = Br, I):
CH3-CHOH-CHto-CHto-CH3 + PBr3 => CH3-CHBr-CHto-CHto-CH3 + H3PO3
Ovenstående kemiske ligning svarer til reaktionen mellem Sec-pentanol og phosphortribromid med oprindelse sec-pentylbromid.
Bemærk, at i begge reaktioner et sekundært alkylhalogenid (RtoCHX).
Dehydrering
I denne reaktion går et H og et OH fra nærliggende kulstof tabt og danner en dobbeltbinding mellem disse to carbonatomer. Derfor er der dannelsen af en alken. Reaktionen kræver en syrekatalysator og tilførsel af varme.
Alkohol => Alken + HtoELLER
For eksempel har vi følgende reaktion:
Cyclohexanol => Cyclohexen + HtoELLER
Reaktion med aktive metaller
Sekundære alkoholer kan reagere med metaller:
CH3-CHOH-CH3 + K => CH3CHO-K+CH3 + ½ H+
Her reagerer isopropylalkohol med kalium for at danne isoproxidsaltet af kalium og hydrogenioner..
Forestring
Den sekundære alkohol reagerer med en carboxylsyre til dannelse af en ester. For eksempel er den kemiske ligning til omsætning af sec-butylalkohol med eddikesyre til fremstilling af sec-butylacetat vist:
CH3CHOHCHtoCH3 + CH3COOH <=> CH3COOCHCH3CHtoCH3
Oxidation
Primære alkoholer oxideres til aldehyder, og disse oxideres igen til carboxylsyrer. Men de sekundære alkoholer oxideres til acetone. Reaktioner katalyseres normalt af kaliumdichromat (KtoCrO7) og kromsyre (HtoCrO4).
Den samlede reaktion er:
RtoCHOH => RtoC = O
Nomenklatur
Sekundære alkoholer er navngivet, hvilket angiver positionen for OH-gruppen i den vigtigste (længste) kæde. Dette nummer går foran navnet, eller det kan komme efter navnet på den respektive alkan for nævnte kæde.
For eksempel CH3CHtoCHtoCHtoCHOHCH3, er 2-hexanol eller hexan-2-ol.
Hvis strukturen er cyklisk, er der ikke behov for at placere en tæller. medmindre der er andre substituenter. Dette er grunden til, at den cykliske alkohol i det andet billede kaldes cyclohexanol (ringen er sekskantet).
Og for den anden alkohol med det samme billede (den forgrenede) er dens navn: 6-ethyl-heptan-2-ol.
Ansøgninger
-Sec-butanol anvendes som opløsningsmiddel og kemisk mellemprodukt. Det er til stede i hydrauliske væsker til bremser, industrielle rengøringsmidler, poleringsmidler, malingstrippere, mineralflydningsmidler og frugtessenser og parfume..
-Isopropanolalkohol anvendes som et industrielt opløsningsmiddel og som et antikoagulant. Det bruges i olier og hurtigtørrende blæk som et antiseptisk middel og erstatning for ethanol i kosmetik (for eksempel: hudcremer, hårfarver og spritalkohol).
-Isopropanol er en ingrediens i flydende sæbe, glasrensere, syntetiske smagsstoffer i ikke-alkoholiske drikkevarer og fødevarer. Derudover er det et mellemkemikalie.
-Cyclohexanol bruges som opløsningsmiddel til tekstilfinish, til læderbearbejdning og som emulgator i sæber og syntetiske rengøringsmidler..
-Methylcyclohexanol er en ingrediens i sæbebaserede pletfjernere og specialvaskemidler.
Eksempler
2-oktanol

Det er en fed alkohol. Det er en farveløs væske, let opløselig i vand, men opløselig i de fleste ikke-polære opløsningsmidler. Det bruges blandt andet til produktion af smagsstoffer og duftstoffer, maling og belægning, blæk, klæbemidler, hjemmepleje og smøremidler.
Estradiol eller 17β-Estradiol

Det er et steroid kønshormon. Den har to hydroxylgrupper i sin struktur. Det er det dominerende østrogen i reproduktive år.
20-hydroxy-leukotrien
Det er en metabolit, der sandsynligvis stammer fra oxidationen af leukotrienlipid. Det er klassificeret som en cystinylleukotrien. Disse forbindelser er formidlere af den inflammatoriske proces, der bidrager til de patofysiologiske egenskaber ved allergisk rhinitis..
2-Heptanol
Det er en alkohol, der findes i frugt. Det findes også i ingefærolie og jordbær. Det er gennemsigtigt, farveløst og uopløseligt i vand. Det bruges som opløsningsmiddel til forskellige harpikser og griber ind i flotationsfasen i mineralforarbejdning.
Referencer
- James. (17. september 2014). Alkoholer (1) - Nomenklatur og egenskaber. Gendannet fra: masterorganicchemistry.com
- Encyclopædi for sundhed og sikkerhed på arbejdspladsen. (s.f.). Alkoholer. [PDF]. Gendannet fra: insht.es
- Clark J. (16. juli 2015). Struktur og klassificering af alkoholer. Kemi Libretexts. Gendannet fra: chem.libretexts.org
- PubChem. (2019). 20-hydroxy-leukotrien E4. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kemi. 5ta Udgave. Redaktionel Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10th udgave.). Wiley plus.
- Wikipedia. (2018). 2-oktanol. Gendannet fra: en.wikipedia.org



Endnu ingen kommentarer