
Alkynes egenskaber, struktur, anvendelser og eksempler
Det alkyner De er carbonhydrider eller organiske forbindelser, der har en tredobbelt binding mellem to carbonatomer i deres strukturer. Denne tredobbelte binding (≡) betragtes som en funktionel gruppe, da den repræsenterer et aktivt sted i molekylet og derfor er ansvarlig for deres reaktivitet.
Selvom alkyner ikke er meget forskellige fra alkaner eller alkener, udviser de større surhed og polaritet på grund af deres bindings beskaffenhed. Det nøjagtige udtryk for at beskrive denne lille forskel er, hvad der er kendt som umættethed.

Alkaner er mættede kulbrinter, mens alkyner er de mest umættede i forhold til den oprindelige struktur. Hvad betyder det? At en alkan H3C-CH3 (ethan) kan dehydrogeneres til HtoC = CHto (ethen) og senere til HC2CH (ethyne eller bedre kendt som acetylen).
Bemærk, hvordan antallet af hydrogenbinder, der er bundet til dem, falder, når der dannes yderligere bindinger mellem kulstofferne. Kulstof på grund af dets elektroniske egenskaber søger at danne fire enkle bindinger, så jo højere umættetheden er, desto større er tendensen til at reagere (med undtagelse af aromatiske forbindelser).
På den anden side er den tredobbelte binding meget stærkere end dobbeltbindingen (=) eller enkeltbindingen (-), men til en høj energipris. Derfor kan de fleste carbonhydrider (alkaner og alkener) danne tredobbelte bindinger ved forhøjede temperaturer..
Som en konsekvens af disse høje energier, og når de går i stykker, frigiver de en masse varme. Et eksempel på dette fænomen ses, når acetylen brændes med ilt, og den intense varme fra flammen bruges til at svejse eller smelte metaller (øverste billede).
Acetylen er den enkleste og mindste alkyn af alle. Andre carbonhydrider kan udtrykkes ud fra dets kemiske formel ved at erstatte H med alkylgrupper (RC≡CR '). Det samme sker i en verden af organisk syntese gennem et stort antal reaktioner.
Denne alkyn produceres ved omsætning af calciumoxid fra kalksten og koks, et råmateriale, der giver de nødvendige kulstoffer i en elektrisk ovn:
CaO + 3C => CaCto + CO
CaCto Det er calciumcarbid, en uorganisk forbindelse, der omsider reagerer med vand til dannelse af acetylen:
CaCto + 2HtoO => Ca (OH)to + HC2CH
Artikelindeks
- 1 Fysiske og kemiske egenskaber af alkyner
- 1.1 Polaritet
- 1.2 Surhed
- 2 Reaktivitet
- 2.1 Hydrogenering
- 2.2 Tilsætning af hydrogenhalogenider
- 2.3 Hydrering
- 2.4 Tilsætning af halogener
- 2.5 Alkylering af acetylen
- 3 Kemisk struktur
- 3.1 Afstand mellem forbindelserne og terminale alkyner
- 4 Nomenklatur
- 5 anvendelser
- 5.1 Acetylen eller ethyne
- 5.2 Naturlige alkyner
- 6 Eksempler på alkyner
- 6.1 Taririnsyre
- 6.2 Histrionicotoxin
- 6.3 Cicutoxin
- 6.4 Capillin
- 6.5 Pargyline
- 7 Referencer
Fysiske og kemiske egenskaber af alkyner
Polaritet
Den tredobbelte binding adskiller alkyner fra alkaner og alkener. De tre typer kulbrinter er apolære, uopløselige i vand og meget svage syrer. Elektronegativiteten for dobbelt- og tredobbeltbindingskulhydrater er imidlertid større end for enkeltkulstofferne..
Følgelig giver kulstofferne, der støder op til den tredobbelte binding, negativ ladningstæthed ved induktiv virkning. Af denne grund, hvor C≡C- eller C = C-bindingerne er, vil der være en højere elektrondensitet end i resten af carbonskelettet. Som en konsekvens er der et lille dipolmoment, hvorved molekylerne interagerer med dipol-dipolkræfter..
Disse interaktioner er meget svage, hvis deres dipolmomenter sammenlignes med vandmolekylets eller anden alkohol. Dette afspejles i deres fysiske egenskaber: alkyner har generelt højere smelte- og kogepunkter sammenlignet med deres mindre umættede kulbrinter..
På grund af deres lave polaritet er de ligeledes mindre uopløselige i vand, men de er opløselige i ikke-polære organiske opløsningsmidler såsom benzen..
Surhed
Denne elektronegativitet forårsager også brint HC≡CR er surere end nogen anden til stede i andre carbonhydrider. Derfor er alkyner mere sure arter end alkener og meget mere sure end alkaner. Imidlertid er dens surhed stadig ubetydelig sammenlignet med den for carboxylsyrer..
Da alkyner er meget svage syrer, reagerer de kun med meget stærke baser, såsom natriumamid:
HC2CR + NaNHto => HC2CNa + NH3
Fra denne reaktion opnås en opløsning af natriumacetylid, råmateriale til syntese af andre alkyner..
Reaktivitet
Alkynernes reaktivitet forklares ved tilsætningen af små molekyler til deres tredobbelte binding, hvilket mindsker deres umættethed. Disse kan meget vel være hydrogenmolekyler, hydrogenhalogenider, vand eller halogener..
Hydrogenering
Det lille molekyle af Hto det er meget undvigende og hurtigt, så for at øge chancerne for, at de føjes til den tredobbelte binding af alkyner, skal der anvendes katalysatorer.
Disse er normalt metaller (Pd, Pt, Rh eller Ni) fint opdelt for at øge overfladearealet; og således kontakten mellem hydrogen og alkyn:
RC≡CR '+ 2Hto => RCHtoCHtoR '
Resultatet er, at hydrogenet "forankres" til carbonerne, der bryder en binding, og så videre, indtil der produceres den tilsvarende alkan, RCHtoCHtoR '. Dette mætter ikke kun det oprindelige carbonhydrid, men ændrer også dets molekylære struktur..
Tilsætning af hydrogenhalogenider
Her tilføjes det uorganiske molekyle HX, hvor X kan være en hvilken som helst af halogenerne (F, Cl, Br eller I):
RC≡CR '+ HX => RCH = CXR'
Hydrering
Hydrering af alkyner er, når de tilføjer et vandmolekyle til dannelse af et aldehyd eller en keton:
RC≡CR '+ HtoO => RCHtoCOR '
Hvis R 'er et H, er det et aldehyd; hvis det er en alkyl, så er det en keton. I reaktionen dannes en forbindelse kendt som enol (RCH = C (OH) R ') som et mellemprodukt..
Dette gennemgår en konvertering fra enolform (C-OH) til ketonform (C = O) i en ligevægt kaldet tautomerisering.
Tilsætning af halogener
Og med hensyn til tilføjelser er halogenernes diatomiske molekyler (Xto= Fto, Clto, Brto jeg hørteto):
RC≡CR '+ 2Xto => RCXto-CXtoR '
Acetylenalkylering
Andre alkyner kan fremstilles ud fra natriumacetylidopløsningen ved anvendelse af et alkylhalogenid:
HC2CNa + RX => HC2CR + NaX
For eksempel, hvis det var methyliodid, ville den resulterende alkyn være:
HC2CNa + CH3I => HC2CCH3 + NaX
HC2CCH3 er tip, også kendt som methylacetylen.
Kemisk struktur
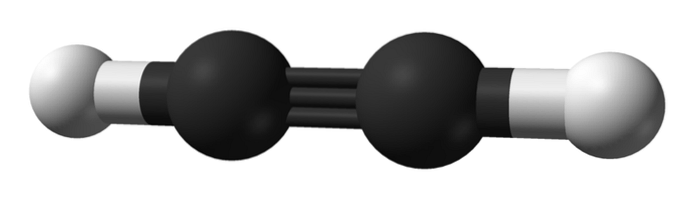
Hvad er strukturen af alkyner? Et acetylenmolekyle er vist i det øverste billede. Ud fra det kan den lineære geometri af bindingen C enlaceC observeres tydeligt.
Derfor, hvor der er en tredobbelt binding, skal strukturen af molekylet være lineær. Dette er en anden af de bemærkelsesværdige forskelle mellem dem og resten af kulbrinterne.
Alkaner er normalt repræsenteret som zigzags, fordi de har SP-hybridisering3 og deres links er 109º fra hinanden. De er faktisk en kæde af kovalent bundet tetraeder. Mens alkenerne er flade ved sp-hybridiseringto af dets kulstoffer, mere specifikt danner et trigonal plan med bindinger adskilt af 120º.
I alkyner er orbital hybridisering sp, det vil sige, de har 50% s karakter og 50% p karakter. Der er to hybrid-sp-orbitaler, der binder til H-atomer i acetylen eller til alkylgrupper i alkyner..
Afstanden mellem de to H eller R er 180 ° ud over det faktum, at kun på denne måde kan de rene p-orbitaler i kulstofferne danne den tredobbelte binding. Af denne grund er bindingen -C≡C- lineær. Når man ser på strukturen af ethvert molekyle, skiller -C≡C- sig ud i de regioner, hvor skeletet er meget lineært.
Afstanden mellem forbindelserne og terminale alkyner
Kulstofferne i den tredobbelte binding er tættere på hinanden end i dobbelt- eller enkeltbindingen. Med andre ord er C2C kortere end C = C og C-C. Som en konsekvens er bindingen stærkere, fordi de to π-bindinger hjælper med at stabilisere den enkelte σ-binding..
Hvis den tredobbelte binding er i slutningen af en kæde, er det en terminal alkyn. Derfor skal formlen for den nævnte forbindelse være HC2CR, hvor H fremhæver slutningen eller begyndelsen af kæden.
Hvis det tværtimod er en intern tredobbelt binding, er formlen RC≡CR ', hvor R og R' er højre og venstre side af kæden.
Nomenklatur
Hvordan navngives alkyner i henhold til reglerne dikteret af IUPAC? På samme måde som alkaner og alkener er blevet navngivet. For at gøre dette ændres suffikset -ano eller -eno til suffikset -ino.
For eksempel: HC≡CCH3 det hedder propyne, da det har tre carbonatomer, som propan (CH3CHtoCH3). HC≡CCHtoCH3 er 1-butyne, som er en terminal alkyn. Men i tilfælde af CH3C≡CCH3 det er 2-butyne, og i dette er den tredobbelte binding ikke terminal, men intern.
CH3C≡CCHtoCHto(CH3)to er 5-methyl-2-hexyne. Kulstofferne tælles fra den side, der er tættest på tredobbeltbindingen.
En anden type alkyner er cycloalkiner. For dem er det nok at erstatte suffikset -ano med -ino af den tilsvarende cycloalkane. Således navngives cyclopropan, der har en tredobbelt binding, som cyclopropino (som ikke findes).
Når der er to tredobbelte obligationer, føjes præfikset di- til navnet. Eksempler er HC2C-C2H, diacetylen eller propadino; og til HC2C-C-C2H, butadiino.
Ansøgninger
Acetylen eller ethyn
Den mindste af alkynerne fortykker det mulige antal anvendelser af disse kulbrinter. Fra det gennem alkyleringer kan andre organiske forbindelser syntetiseres. Ligeledes gennemgår det oxidative reaktioner for at opnå blandt andet ethanol, eddikesyre, acrylsyre..
Andet af dets anvendelser består i at tilvejebringe varmekilden til at excitere atonernes elektroner; mere specifikt af metalkationer i atomabsorption-emissionsbestemmelser, en meget anvendt spektroskopisk teknik.
Naturlige alkyner
De eneste eksisterende metoder til fremstilling af alkyner er ikke kun syntetiske eller med påføring af varme i fravær af ilt, men også biologiske.
Disse bruger enzymer kaldet acetylenaser, som kan dehydrogenere en dobbeltbinding. Takket være dette opnås mange naturlige kilder til alkyner.
Som et resultat af dette kan gift, modgift, medicin eller enhver anden forbindelse, der giver en vis fordel, ekstraheres fra disse kilder; især når det drejer sig om sundhed. Alternativerne er mange, når man ændrer deres originale strukturer og har dem som understøttelse af nye alkyner..
Eksempler på alkyner
Indtil videre er adskillige eksempler på alkyner blevet nævnt. Nogle kommer imidlertid fra meget specifikke kilder eller har særlige molekylære strukturer: de er polyacetylener.
Dette betyder, at der kan være mere end en tredobbelt binding, der er en del af en meget stor struktur og ikke kun en simpel kulstofkæde..
Taririnsyre

Tarirsyre kommer fra en plante i Guatemala kaldet Picramnia tariri. Det ekstraheres specifikt fra olien fra dets frø.
I sin molekylære struktur kan der observeres en enkelt tredobbelt binding, der adskiller en apolar hale fra et polært hoved; derfor kunne det betragtes som et amfipatisk molekyle.
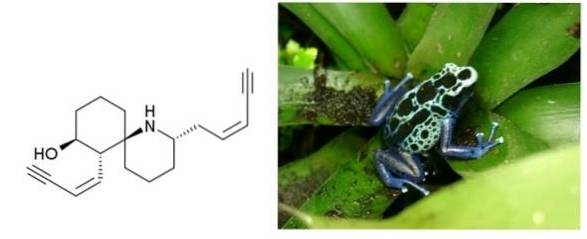
Histrionikotoksin
på en.wikipedia [Public domain], fra Wikimedia Commons
Histrionikotoksin er en gift, der udskilles af frøens hud, der bor i Colombia, Brasilien og andre latinamerikanske lande. Den har to tredobbelte bånd konjugeret til en dobbeltbinding. Begge er terminale og adskilt af en seks-carbonring og en cyklisk amin..
Cicutoxin
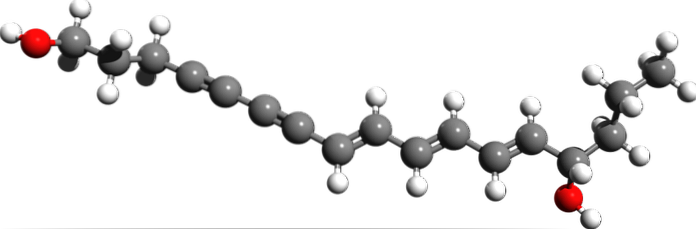
Fra den molekylære struktur af Cicutoxin, hvor er de tredobbelte bindinger? Hvis dobbeltbindingerne er flade, set til højre, og enkeltbindingerne er tetraedriske, som i enderne er tredoblingerne lineære og er på skråningen (\).
Denne forbindelse består af et neurotoksin, der primært findes i den akvatiske hemlock-plante..
Capillina
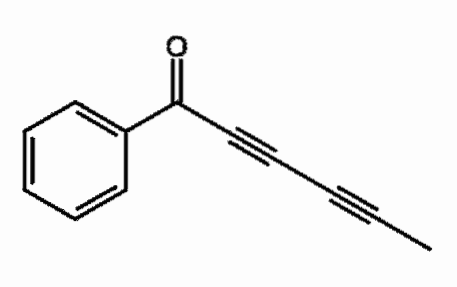
Det er en alkyne, der findes i den æteriske olie fra krusplanter, der bruges som et svampedræbende middel. To på hinanden følgende tredobbelte bindinger kan observeres, mere korrekt konjugeret.
Hvad betyder det? De tredobbelte bindinger resonerer gennem hele carbonkæden og involverer C = O dobbeltbindingsåbning til C-O-.
Pargyline
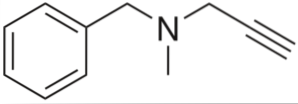
Det er en alkyn med antihypertensiv aktivitet. Når vi analyserer dens struktur efter dele, har vi: en benzylgruppe til venstre, en tertiær amin i midten og en propynyl til højre; det vil sige en terminal propygruppe.
Referencer
- Francis A. Carey. Organisk kemi. Carboxylsyrer. (sjette udgave, s. 368-397). Mc Graw Hill.
- Brennan, John. (10. marts 2018). Eksempler på Alkynes. Videnskabelig. Hentet fra: sciencing.com
- BYJU'S. (2018). Triple Bond i Alkynes. Hentet fra: byjus.com
- Eksempler på encyklopædi (2017). Alkynes. Gendannet fra: eksempler.co
- Kevin A. Boudreaux. Alkynes. Hentet fra: angelo.edu
- Robert C. Neuman, Jr. Alkenes og Alkynes. [PDF]. Hentet fra: chem.ucr.edu


Endnu ingen kommentarer