
Trinitrotoluen (TNT) struktur, egenskaber, anvendelser, risici, eksplosion
Det trinitrotoluen er en organisk forbindelse, der består af kulstof, ilt, brint og nitrogen med tre nitro-NO-grupperto. Dens kemiske formel er C6Hto(CH3)(IKKEto)3 eller også den kondenserede formel C7H5N3ELLER6.
Dets fulde navn er 2,4,6-trinitrotoluen, men det er almindeligt kendt som TNT. Det er et hvidt krystallinsk fast stof, der kan eksplodere, når det opvarmes over en bestemt temperatur.

Tilstedeværelsen i trinitrotoluen af de tre nitro-NO-grupperto favoriserer det faktum, at det eksploderer med en vis lethed. Af denne grund er det blevet brugt i vid udstrækning i eksplosive enheder, projektiler, bomber og granater..
Det er også blevet brugt til sprængning under vand, i dybe brønde og til industrielle eller ikke-krigseksplosioner..
TNT er et delikat produkt, der også kan eksplodere fra meget stærke slag. Det er også giftigt for mennesker, dyr og planter. De steder, hvor deres eksplosioner har fundet sted, er blevet forurenet, og der udføres undersøgelser for at eliminere resterne af denne forbindelse.
En måde, der kan være effektiv og billig at reducere koncentrationen af TNT i det forurenede miljø, er ved brug af nogle typer bakterier og svampe..
Artikelindeks
- 1 Kemisk struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Kogepunkt
- 3.5 Flammepunkt
- 3.6 Tæthed
- 3.7 Opløselighed
- 3.8 Kemiske egenskaber
- 4 Eksplosionsproces af TNT
- 4.1 Oxidationsreaktion af TNT
- 5 Sådan opnås TNT
- 6 Anvendelser af TNT
- 6.1 I militære aktiviteter
- 6.2 I industrielle applikationer
- 7 Risici ved TNT
- 8 Forurening af miljøet med TNT
- 8.1 Løsning til TNT-forurening
- 8.2 Oprydning med bakterier og svampe
- 8.3 Afhjælpning med alger
- 9 Referencer
Kemisk struktur
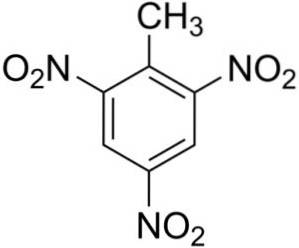
2,4,6-Trinitrotoluen består af et molekyle toluen C6H5-CH3, hvortil der er tilføjet tre nitro-NO-grupperto.
De tre nitro-NO grupperto de er symmetrisk placeret på benzenringen af toluen. De findes i position 2, 4 og 6, hvor position 1 svarer til methyl-CH3.
Nomenklatur
- Trinitrotoluen
- 2,4,6-trinitrotoluen
- TNT
- Trilite
- 2-methyl-1,3,5-trinitrobenzen
Ejendomme
Fysisk tilstand
Farveløst til lysegult krystallinsk fast stof. Nåleformede krystaller.
Molekylær vægt
227,13 g / mol.
Smeltepunkt
80,5 ºC.
Kogepunkt
Det koger ikke. Nedbrydes med en eksplosion ved 240 ºC.
Flashpoint
Det er ikke muligt at måle det, fordi det eksploderer.
Massefylde
1,65 g / cm3
Opløselighed
Næsten uopløselig i vand: 115 mg / L ved 23 ° C. Meget let opløselig i ethanol. Meget opløselig i acetone, pyridin, benzen og toluen.
Kemiske egenskaber
Kan nedbrydes eksplosivt ved opvarmning. Når den når 240 ° C, eksploderer den. Det kan også eksplodere, når der lider meget stærke slag.
Ved opvarmning til nedbrydning producerer det giftige gasser af nitrogenoxider NOx.
TNT eksplosionsproces
Eksplosionen af TNT fører til en kemisk reaktion. Dybest set er det en forbrændingsproces, hvor energi frigives meget hurtigt. Derudover udsendes gasser, som er midler til at overføre energi.

Brændstof og oxidant skal være til stede, før en forbrændingsreaktion (oxidation) kan finde sted.
I tilfælde af TNT er begge i det samme molekyle, da carbon (C) og hydrogen (H) atomer er brændstoffer, og oxidanten er oxygenet (O) i nitro-NO-grupperne.to. Dette gør, at reaktionen kan gå hurtigere.
TNT-oxidationsreaktion
Under TNT's forbrændingsreaktion arrangeres atomerne, og ilt (O) forbliver tættere på kulstof (C). Derudover kvælstof af -NOto reduceres til dannelse af nitrogengas Nto som er en meget mere stabil forbindelse.
Den kemiske eksplosionsreaktion af TNT kan sammenfattes som følger:
2 C7H5N3ELLER6 → 7 CO ↑ + 7 C + 5 HtoO ↑ + 3 Nto↑
Kulstof (C) produceres under eksplosionen i form af en sort sky, og der dannes også kulilte (CO), hvilket skyldes, at der ikke er nok ilt i molekylet til fuldstændigt at oxidere alle carbonatomer (C) og hydrogen (H) til stede.
Opnåelse af TNT
TNT er en forbindelse, der kun er fremstillet kunstigt af mennesket.
Det findes ikke naturligt i miljøet. Findes kun på nogle militære installationer.
Det fremstilles ved nitrering af toluen (C6H5-CH3) med en blanding af salpetersyre HNO3 og svovlsyre HtoSW4. Først får du en blanding af ortho- Y for at-nitrotoluener, der ved efterfølgende energisk nitrering danner det symmetriske trinitrotoluen.
Anvendelse af TNT
I militære aktiviteter
TNT er et eksplosivstof, der er blevet brugt i krigslignende enheder og militære eksplosioner.
Det bruges til at fylde projektiler, granater og luftbårne bomber, da det er ufølsomt over for den modtagne påvirkning til at forlade et våbens tønde, men det kan eksplodere, når det rammes af en detonatormekanisme.

Ikke designet til at producere væsentlig fragmentering eller lancering af projektiler.
I industrielle applikationer
Det er blevet brugt til eksplosioner af industriel interesse i sprængning under vand (på grund af dets uopløselighed i vand) og dybe brøndeksplosioner. Tidligere blev det oftest brugt til nedrivning. Det bruges i øjeblikket sammen med andre forbindelser.

Det har også været en mellemmand for farvestoffer og fotografiske kemikalier.
Risici ved TNT
Kan eksplodere, hvis den udsættes for intens varme, ild eller meget stærke stød.
Det irriterer øjnene, huden og luftvejene. Det er en meget giftig forbindelse både for mennesker og for dyr, planter og mange mikroorganismer..
Symptomer på eksponering for TNT inkluderer hovedpine, svaghed, anæmi, toksisk hepatitis, cyanose, dermatitis, leverskader, konjunktivitis, dårlig appetit, kvalme, opkastning, diarré, blandt andre..
Det er et mutagen, det vil sige, det kan ændre en organisms genetiske information (DNA) og forårsage ændringer, der kan relateres til udseendet af arvelige sygdomme.
Det er også blevet klassificeret som kræftfremkaldende eller kræftgenerator.
Forurening af miljøet med TNT
TNT er blevet opdaget i jord og vand i områder med militær krigsførelse, på ammunitionsproduktionssteder og hvor militær træningsoperationer udføres..

Forurening med TNT er farlig for dyr, mennesker og planter. Selvom TNT i øjeblikket anvendes i mindre mængder, er det en af de nitroaromatiske forbindelser, der er blevet brugt mest i sprængstofindustrien..
Af denne grund er det en af dem, der bidrager mest til miljøforurening..
Løsning til forurening med TNT
Behovet for at "rense" regioner, der er forurenet med TNT, har motiveret udviklingen af flere saneringsprocesser. Udbedring er fjernelse af forurenende stoffer fra miljøet.
Afhjælpning med bakterier og svampe
Mange mikroorganismer er i stand til at bioremedicere TNT, såsom bakterier af slægten Pseudomonas, Enterobacter, Mycobacterium Y Clostridium.
Det har også vist sig, at der er visse bakterier, der har udviklet sig steder, der er forurenet med TNT, og som kan overleve og også nedbryde eller metabolisere det som en næringskilde.
Det Escherichia coli For eksempel har det vist en enestående kapacitet til biotransformation af TNT, da det har flere enzymer til at angribe det, hvilket samtidig viser en høj tolerance over for dets toksicitet.
Derudover kan nogle svampearter biotransformere TNT og gøre det til ikke-skadelige mineraler..
Algereduktion
På den anden side har nogle forskere fundet ud af, at algen Spirulina platensis har evnen til at adsorbere på overfladen af dine celler og assimilere op til 87% af TNT til stede i vand kontamineret med denne forbindelse.
Tolerancen for disse alger over for TNT og dens evne til at rense vand, der er forurenet med den, indikerer det høje potentiale for disse alger som en phytoremediator..
Referencer
- OS. National Library of Medicine. (2019). 2,4,6-trinitrotoluen. Gendannet fra pubchem.ncbi.nlm.nih.gov.
- Murray, S.G. (2000). Eksplosiver. Eksplosionsmekanisme. I Encyclopedia of Forensic Sciences 2000, sider 758-764. Gendannet fra sciencedirect.com.
- Adamia, G. et al. (2018). Om muligheden for anvendelse af alge Spirulina til fytoremediering af vand, der er forurenet med 2,4,6-trinitrotoluen. Annaler for agrarvidenskab 16 (2018) 348-351. Gendannet fra reader.elsevier.com.
- Serrano-González, M.Y. et al. (2018). Biotransformation og nedbrydning af 2,4,6-trinitrotoluen ved mikrobiel metabolisme og deres interaktion. Defense Technology 14 (2018) 151-164. Gendannet fra pdf.sciencedirectassets.com.
- Iman, M. et al. (2017). Systembiologisk tilgang til bioremediering af nitroaromatika: begrænsningsbaseret analyse af 2,4,6-trinitrotoluen-biotransformation ved Escherichia coli. Molecules 2017, 22, 1242. Gendannet fra mdpi.com.
- Windholz, M. et al. (redaktører) (1983). Merck-indekset. En encyklopædi over kemikalier, lægemidler og biologiske stoffer. Tiende udgave. Merck & CO., Inc..
- Morrison, R.T. og Boyd, R.N. (2002). Organisk kemi. 6. udgave. Prentice-Hall.



Endnu ingen kommentarer