
Beryllium historie, struktur, egenskaber, anvendelser
Det beryllium Det er et metalelement, der hører til gruppe 2 eller IIA i det periodiske system. Det er det letteste jordalkalimetal i gruppen og er repræsenteret af symbolet Be. Dets atom og kation er også mindre end dets kongenerer (Mg, Ca, Sr ...).
På grund af sin usædvanlige ladningstæthed forekommer dette metal normalt ikke isoleret. Cirka 30 mineraler vides at indeholde det, blandt hvilke er: beryl (3BeOAltoELLER36SiOto2HtoO), bertrandit (4BeO.2SiOto.2HtoO), chrysoberyl (BeAltoELLER4) og fenaquita (BetoJa4).

Smaragd, en ædelsten, er en variant af beryl. Imidlertid er ren beryllium ikke så slående; den har lysegrå glitter (øverste billede) og er opnået i form af frø eller pastiller.
Beryllium har et sæt karakteristiske fysiske egenskaber. Det har en lav densitet; høje termiske og elektriske ledninger såvel som dets termiske kapacitet og varmeafledning det er ikke et magnetisk metal; og har også en passende kombination af stivhed og elasticitet.
Alle disse egenskaber har ført til, at beryllium er et metal med mange anvendelser, lige fra dets anvendelse i legeringer med kobber til fremstilling af værktøjer, til dets anvendelse i raketter, fly, biler, atomreaktorer, røntgenudstyr, resonans nuklear magnetisk, etc.
Beryllium har 10 kendte isotoper, der spænder fra 5Vær en 14Vær, være den 9Vær den eneste stabile. Ligeledes er det et meget giftigt metal, der især påvirker luftvejene, så der er en begrænsning i dets anvendelse..
Artikelindeks
- 1 Historie om dets opdagelse
- 2 Struktur af beryllium
- 3 Elektronisk konfiguration
- 4 egenskaber
- 4.1 Fysisk beskrivelse
- 4.2 Smeltepunkt
- 4.3 Kogepunkt
- 4.4 Tæthed
- 4.5 Atomeradius
- 4.6 Kovalent radius
- 4.7 Atomvolumen
- 4.8 Specifik varme
- 4.9 Fusionsvarme
- 4.10 Fordampningsvarme
- 4.11 Elektronegativitet
- 4.12 Standardpotentiale
- 4.13 Lydens hastighed
- 4.14 Termisk ekspansion
- 4.15 Varmeledningsevne
- 4.16 Kemiske egenskaber
- 5 applikationer
- 5.1 Udvikling af værktøjer
- 5.2 Fremstilling af spejle
- 5.3 I ioniserende stråling
- 5.4 I udstyr til magnetisering
- 5.5 Atomreaktorer
- 5.6 Metalbeskytter
- 6 Hvor er?
- 7 risici
- 8 Referencer
Historie om dets opdagelse
Beryllium blev opdaget af Louis-Nicolas Vauguelin i 1798 som et kompositionselement af mineralet beryl og et silikat af aluminium og beryllium.
Senere lykkedes den tyske kemiker Frederic Wöhler i 1828 at isolere beryllium ved at reagere kalium med berylliumchlorid i en platinedigel..
Samtidig og uafhængigt opnåede den franske kemiker Antoine Bussy også isoleringen af beryllium. Wöhler var den første til at foreslå navnet beryllium for metallet.
Det fik sit nuværende navn i 1957, da det tidligere var kendt som glucinium på grund af den søde smag af nogle af dets salte. Men for at undgå forveksling med andre søde smagsstoffer og med en plante kaldet glucin blev det besluttet at ændre navn til beryllium..
Struktur af beryllium
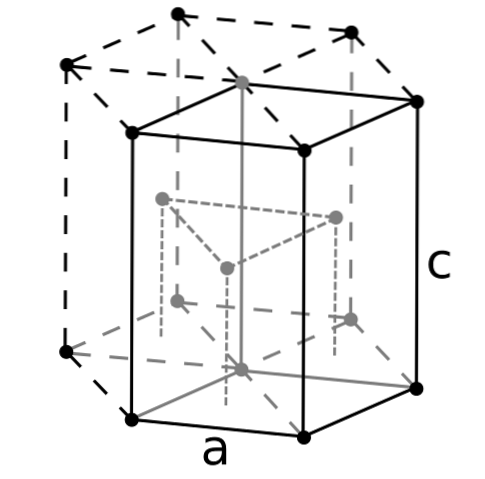
Beryllium er det letteste af jordalkalimetaller, og det forventes, at dets atomer rummer det mindste af alle. Berylliumatomer interagerer med hinanden gennem den metalliske binding på en sådan måde, at deres "hav af elektroner" og frastødningerne mellem kernerne former strukturen for den resulterende krystal..
De sorte krystaller af beryllium dannes derefter. Disse krystaller har en sekskantet struktur (øverste billede), hvor hvert Be-atom har seks side naboer, og yderligere tre i flyene over og under..
Da krystallerne er sorte, er det nyttigt at forestille sig, at de sorte punkter i den sekskantede struktur erstattes af berylliumatomer. Dette er en af de mest kompakte strukturer, som et metal kan vedtage; og det giver mening, at de meget små atomer i Be "presses" så meget for at undgå den mindste mængde tomrum eller antal huller imellem dem.
Elektronisk konfiguration
1sto2sto
Hvilket er lig med 4 elektroner, hvoraf 2 har valens. Hvis en elektron promoveres til 2p-orbitalen, vil vi have to sp hybridorbitaler. Således kan der i berylliumforbindelser være lineære geometrier, X-Be-X; for eksempel det isolerede molekyle af BeClto, Cl-Be-Cl.
Ejendomme
Fysisk beskrivelse
Blank, sprød, stålgrå fast.
Smeltepunkt
1287 ºC.
Kogepunkt
2471 ºC.
Massefylde
- 1,848 g / cm3 ved stuetemperatur.
- 1,69 g / cm3 til smeltepunkt (flydende tilstand).
Atomic radio
112.
Kovalent radius
90.00.
Atomisk volumen
5 cm3/ mol.
Specifik varme
1.824 J / gmol ved 20 ºC.
Fusionsvarme
12,21 kJ / mol.
Fordampningsvarme
309 kJ / mol.
Elektronegativitet
1,57 på Pauling-skalaen.
Standardpotentiale
1,70 V..
Lydens hastighed
12.890 m / s.
Varmeudvidelse
11,3 µm / m K ved 25 ºC.
Varmeledningsevne
200 w / m K.
Kemiske egenskaber
Beryllium er belagt med et lag berylliumoxid (BeO), der beskytter det i luft ved stuetemperatur. Oxidationen af beryllium forekommer ved temperaturer over 1000 ºC, der stammer fra produkterne berylliumoxid og berylliumnitrid.
Det er også modstandsdygtigt over for salpetersyrens virkning 15 M. Men det opløses i saltsyre og baser, såsom natriumhydroxid..
Ansøgninger
Værktøjsfremstilling
Beryllium danner legeringer med kobber, nikkel og aluminium. Især producerer legeringen med kobber værktøjer med stor hårdhed og modstandsdygtighed, der kun udgør 2% af legeringens vægt..
Disse værktøjer producerer ikke gnister, når de rammer jern, hvilket gør det muligt for dem at blive brugt i miljøer med et højt indhold af brændbare gasser..
På grund af dens lave densitet har den en let vægt, som sammen med sin stivhed tillader dens anvendelse i rumfly, raketter, missiler og fly. Legeringen med beryllium er blevet brugt til fremstilling af bildele. Det er også blevet brugt til produktion af fjedre.
På grund af den store hårdhed, som beryllium giver dets legeringer, er de blevet brugt i bremserne på militærfly.
Spejlfremstilling
Beryllium er blevet brugt til fremstilling af spejle på grund af dets dimensionelle stabilitet og dets evne til at være stærkt poleret. Disse spejle bruges i satellitter og i brandkontrolsystemer. Derudover bruges de i rumteleskoper.
I ioniserende stråling
Beryllium er et element med lav densitet, så det kan betragtes som gennemsigtigt for røntgenstråler. Denne egenskab tillader dets anvendelse i konstruktionen af vinduerne på de rør, der producerer røntgenstråler, til industriel anvendelse og til medicinsk diagnose..
Beryllium bruges også i vinduerne til radioaktive emissionsdetektorer..
I magnetisme-genererende udstyr
Blandt egenskaberne ved beryllium er, at det ikke er et magnetisk element. Dette gør det muligt at bruge det til konstruktion af genstande fra magnetisk resonansudstyr, hvor der genereres magnetfelter med høj intensitet, hvilket minimerer enhver interferens.
Atomreaktorer
På grund af dets høje smeltepunkt har det fundet anvendelse i atomreaktorer og keramik. Beryllium bruges som moderator for nukleare reaktioner og som producent af neutroner:
9Være + 4Han (α) => 12C + n (neutron)
Det anslås, at der produceres op til 30 millioner neutroner for en million berylliumatomer, der bombarderes med α-partikler. Netop denne nukleare reaktion tillod opdagelsen af neutronen.
James Chadwick bombarderede berylliumatomer med α (He) -partikler. Forskeren observerede frigivelsen af subatomære partikler uden elektrisk ladning, hvilket førte til opdagelsen af neutroner.
Metalbeskytter
Tilføjelse af en mængde beryllium på overfladen af metaller, der kan oxideres, giver dem en vis beskyttelse. For eksempel reduceres antændeligheden af magnesium, og glansen af sølvlegeringer forlænges.
Hvor er det placeret?
Beryl findes i pegmatit, der er forbundet med glimmer, feltspat og kvarts. Ved at anvende en flotationsteknik adskilles en blanding af beryl og feltspat. Derefter koncentreres feltspat og beryl og underkastes en behandling med calciumhypochlorit..
Efterfulgt af en behandling med svovlsyre og kaliumsulfonat ved hjælp af en fortynding opnås flydningen af beryl, der adskiller den fra feltspat.
Beryl behandles med natriumfluorosilikat og sodavand ved 770 ° C til dannelse af natriumfluorobylat, aluminiumoxid og siliciumdioxid. Berylliumhydroxid udfældes derefter fra natriumfluoroberylatopløsningen med natriumhydroxid.
Berylliumfluorid dannes ved omsætning af berylliumhydroxid med ammoniakhydrogenfluorid, hvorved der dannes ammoniumtetrafluroberylat. Dette opvarmes til dannelse af berylliumfluorid, som varmebehandles med magnesium for at isolere beryllium..
Risici
Beryllium som findelt metal i form af opløsninger, tørt pulver eller røg er meget giftigt og kan forårsage dermatitis. Den største toksicitet frembringes dog ved indånding.
Oprindeligt kan beryllium fremkalde en overfølsomhed eller allergi, som kan udvikle sig til berylliose eller kronisk berylliumsygdom (CBD). Dette er en alvorlig sygdom, der er kendetegnet ved et fald i lungekapaciteten.
Akut sygdom er sjælden. Ved kronisk sygdom dannes granulomer i hele kroppen, især i lungerne. Kronisk berylliose forårsager progressiv dyspnø, hoste og generel svaghed (asteni).
Akut berylliose kan være dødelig. I berylliose forekommer det gradvise tab af åndedrætsfunktion, da der er obstruktion i strømmen af gasser i luftvejene og nedsat iltning af det arterielle blod.
Referencer
- Royal Society of Chemistry. (2019). Beryllium. Gendannet fra: rsc.org
- National Center for Biotechnology Information. (2019). Beryllium. PubChem-database. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Helmenstine, Anne Marie, Ph.D. (15. marts 2019). Beryllium Fakta. Gendannet fra: thoughtco.com
- Wikipedia. (2019). Beryllium. Gendannet fra: en.wikipedia.org
- Lenntech B. V. (2019). Beryllium-Be. Gendannet fra: lenntech.com
- Materio Corporation. (2019). Lær om elementet beryllium Gendannet fra: beryllium.com
- D. Michaud. (2016, 12. april). Beryllium behandling & udvinding problem. 911 Metallurg. Gendannet fra: 911metallurgist.com
- Timothy P. Hanusa. (5. januar 2016). Beryllium. Encyclopædia Britannica. Gendannet fra: britannica.com
- Lee S. Newman. (2014). Beryllium sygdom. MSD Manual. Gendannet fra: msdmanuals.com



Endnu ingen kommentarer