
Gasser egenskaber, adfærd, form, eksempler

Det gasser De er alle de stoffer eller forbindelser, hvis aggregeringstilstande er svage og spredte, samtidig med at de i høj grad afhænger af de tryk- og temperaturforhold, der styrer dem. De er måske den næstmest forekommende form for stof i hele universet efter plasma..
På Jorden udgør gasser atmosfærens lag, fra eksosfæren til troposfæren og den luft, vi indånder. Selvom en gas er usynlig, når den diffunderes gennem store rum, såsom himlen, detekteres den ved bevægelse af skyer, drejningerne fra en mølles vinger eller af dampene, der udåndes fra vores mund i kolde klimaer..

Når man går til de negative miljømæssige aspekter, observeres det i den sorte røg fra køretøjernes udstødningsrør, i røgsøjlerne i tårnene i fabrikkerne eller i røg, der rejses, når en skov brænder.
Du står også over for gasformige fænomener, når du ser dampe, der kommer ud af kloakkerne, i sumpene og kirkegårde, i boblen inde i akvariet, i heliumballonerne, der frigives til himlen, i det ilt, der frigives af planter som et resultat af deres fotosyntese og endda i bøjninger og flatulens.
Uanset hvor der observeres gasser, betyder det, at der var en kemisk reaktion, medmindre de er fikseret eller assimileret direkte fra luften, den største kilde til gasser (overfladisk) på planeten. Når temperaturen stiger, vil alle stoffer (kemiske grundstoffer) omdannes til gasser, herunder metaller som jern, guld og sølv..
Uanset den kemiske karakter af gasser deler de alle fælles den store afstand, der adskiller deres partikler (atomer, molekyler, ioner osv.), Som bevæger sig kaotisk og vilkårligt gennem et givet volumen eller rum..
Artikelindeks
- 1 Egenskaber for gasser
- 1.1 Fysisk
- 1.2 Elektrisk og termisk ledningsevne
- 1.3 Reaktivitet
- 2 Opførsel af gasser
- 3 Form af gasser
- 4 Tryk på en gas
- 4.1 Enheder
- 5 Volumen af en gas
- 6 Vigtigste gaslove
- 6.1 Boyles lov
- 6.2 Charles Law
- 6.3 Gay-Lussacs lov
- 6.4 Avogadros lov
- 7 Typer af gasser
- 7.1 Brændbare gasser
- 7.2 Industrielle gasser
- 7.3 Inerte gasser
- 8 Eksempler på gasformige grundstoffer og forbindelser
- 8.1 Gasformige forbindelser
- 9 Referencer
Gassers egenskaber
Fysisk
Gassernes fysiske egenskaber varierer afhængigt af, hvilket stof eller forbindelse der er involveret. Gasser er populært forbundet med dårlig lugt eller forrådnelse, enten på grund af deres svovlindhold eller tilstedeværelsen af flygtige aminer. Ligeledes visualiseres de med grønlige, brune eller gule farver, der skræmmer og giver en dårlig omen.
Imidlertid er de fleste gasser, eller i det mindste de mest rigelige, faktisk farveløse og lugtfri. Selvom de er undvigende, kan de mærkes på huden, og de modstår bevægelse og skaber endda tyktflydende lag på de kroppe, der passerer gennem dem (som det sker med fly)..
Alle gasser kan gennemgå tryk- eller temperaturændringer, som ender med at gøre dem til deres respektive væsker; det vil sige, de lider under kondens (hvis de afkøles) eller kondensering (hvis de “trykkes”).

På den anden side er gasser i stand til at opløses i væsker og nogle porøse faste stoffer (såsom aktivt kul). Boblerne er resultatet af akkumuleringer af gasser, der endnu ikke er opløst i mediet og flygter mod væskeoverfladen..
Elektrisk og termisk ledningsevne
Under normale forhold (uden ionisering af deres partikler) er gasser dårlige ledere af varme og elektricitet. Men når de er stressede med mange elektroner, tillader de strøm at passere gennem dem, som det ses i lyn under storme..
På den anden side lyser nogle gasser, især de ædle eller perfekte, under lave tryk og udsættes for et elektrisk felt, og deres lys bruges til design af reklamer og natplakater (neonlys) såvel som i berømte elektriske udladningslamper i gadelygter.
Med hensyn til varmeledningsevne opfører mange gasser sig som varmeisolatorer, så deres inkorporering i fyldning af fibre, stoffer eller glaspaneler hjælper med at forhindre varme i at passere gennem dem og holder temperaturen konstant..
Der er dog gasser, der er gode varmeledere og kan forårsage værre forbrændinger end dem, der er forårsaget af væsker eller faste stoffer; for eksempel som med varm damp fra bagte cupcakes (eller empanadas) eller fra dampstråler, der undslipper fra kedler.
Reaktivitet
Generelt klassificeres reaktioner, der involverer gasser, eller hvor de forekommer, som farlige og besværlige.
Deres reaktivitet afhænger igen af deres kemiske natur; Men når man udvider og mobiliserer med stor lethed, skal der udvises større omhu og kontrol, fordi de kan udløse drastiske stigninger i tryk, der sætter reaktorens struktur i fare; for ikke at nævne, hvor brandfarlige eller ikke salige gasser er.
Opførsel af gasser
Makroskopisk kan man få en idé om gassernes opførsel ved at være vidne til, hvordan røg, ringe eller cigaretternes litterære "tunger" udvikler sig i luften. Ligeledes, når en røggranat eksploderer, er det interessant at specificere bevægelsen af disse forskellige farvede skyer.
Imidlertid er sådanne observationer udsat for luftens virkning og også for det faktum, at der er meget fine faste partikler suspenderet i røgen. Derfor er disse eksempler ikke nok til at nå frem til en konklusion med hensyn til en gas sande opførsel. I stedet for er der blevet udført eksperimenter, og den kinetiske teori om gasser er blevet udviklet..
Molekylært og ideelt kolliderer gasformige partikler elastisk med hinanden med lineære, rotations- og vibrationsforskydninger. De har en tilhørende gennemsnitlig energi, som gør det muligt for dem at bevæge sig frit gennem ethvert rum uden næsten at interagere eller kollidere med en anden partikel, når lydstyrken omkring dem øges..
Hans opførsel ville blive en blanding af den uregelmæssige Brownian-bevægelse og kollisionerne mellem nogle billardkugler, der sprang uophørligt mellem hinanden og væggene på bordet; hvis der ikke er nogen vægge, vil de diffundere mod uendelighed, medmindre de holdes tilbage af en kraft: tyngdekraften.
Form af gasser
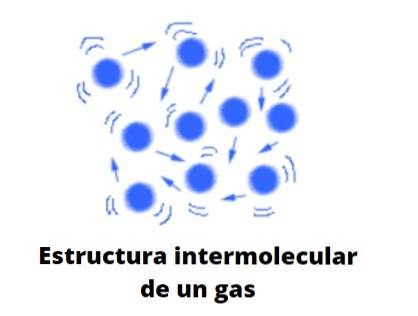
I modsætning til væsker og faste stoffer er gasser ikke noget af den kondenserede type; det vil sige, at aggregering eller samhørighed af dets partikler aldrig formår at definere en form. De deler med væsker det faktum, at de fuldstændigt optager volumenet af beholderen, der indeholder dem; de mangler imidlertid overflade- og overfladespænding.
Hvis gaskoncentrationen er høj, kan dens “tunger” eller de allerede beskrevne makroskopiske former ses med det blotte øje. Disse vil før eller senere ende med at forsvinde ved at påvirke vinden eller ved blot at ekspandere gassen. Gasserne dækker derfor alle hjørner af det begrænsede rum, der stammer fra meget homogene systemer.
Nu betragter teorien bekvemt gasser som kugler, der næppe kolliderer med sig selv; men når de gør det, hopper de elastisk.
Disse kugler er vidt adskilt fra hinanden, så gasserne er praktisk talt "fulde" af vakuum; deraf dens alsidighed til at passere gennem den mindste spalte eller revne og let at være i stand til at komprimere dem markant.
Det er derfor, uanset hvor lukket et bageri er, hvis du går ved siden af det, er det sikkert, at du vil nyde aromaen af nybagt brød..
Tryk på en gas
Det kunne antages, at fordi kuglerne eller partiklerne i gassen er så spredt og adskilt, er de ude af stand til at generere noget pres på legemerne eller objekterne. Atmosfæren viser sig imidlertid, at en sådan tro er falsk: den har masse, vægt og forhindrer væsker i at fordampe eller koge ud af ingenting. Kogepunkter måles ved atmosfærisk tryk.
Gastryk bliver mere kvantificerbare, hvis manometre er tilgængelige, eller hvis de er lukket i beholdere med ikke-deformerbare vægge. Jo flere gaspartikler der er inde i beholderen, jo større er antallet af kollisioner mellem dem og beholderens vægge..
Når disse partikler kolliderer med væggene, presser de dem, da de udøver en kraft, der er proportional med deres kinetiske energi på deres overflade. Det er som om de ideelle billardkugler blev kastet mod en mur; hvis der er mange, der påvirker dem i høj hastighed, kan det endda gå i stykker.
Enheder
Der er mange enheder, der ledsager måling af gastryk. Nogle af de mest kendte er millimeter kviksølv (mmHg), som torr. Der er dem fra det internationale enhedssystem (SI), der definerer pascal (Pa) i form af N / mto; og af ham kilo (kPa), mega (MPa) og giga (GPa) pascal.
Volumen af en gas
En gas optager og ekspanderer gennem hele beholderens volumen. Jo større beholderen er, volumenet af gassen vil også være; men både dets tryk og densitet falder for den samme mængde partikler.
Selve gassen har derimod et tilknyttet volumen, der ikke afhænger så meget af dens natur eller molekylære struktur (ideelt set), men af de tryk- og temperaturforhold, der styrer den; dette er dets molære volumen.
I virkeligheden varierer molvolumenet fra en gas til en anden, selvom variationerne er små, hvis de ikke er store og heterogene molekyler. For eksempel molær volumen af ammoniak (NH3, 22.079 L / mol) ved 0 ºC og 1 atm, adskiller sig fra helium (He, 22.435 L / mol).
Alle gasser har et molært volumen, der ændres som en funktion af P og T, og uanset hvor store deres partikler er, er antallet af dem altid det samme. Herfra afledte han faktisk det, der er kendt af Avogadros nummer (NTIL).
Vigtigste gaslove
Gassers opførsel er blevet undersøgt i århundreder gennem eksperimenter, dybtgående observationer og fortolkning af resultaterne..
Sådanne eksperimenter gjorde det muligt at etablere en række love, der samlet i den samme ligning (den for ideelle gasser) hjælper med at forudsige reaktionerne fra en gas til forskellige betingelser for tryk og temperatur. På denne måde er der et forhold mellem dets volumen, temperatur og tryk såvel som antallet af dets mol i et givet system..
Blandt disse love er følgende fire: Boyle, Charles, Gay-Lussac og Avogadro's.
Boyles lov
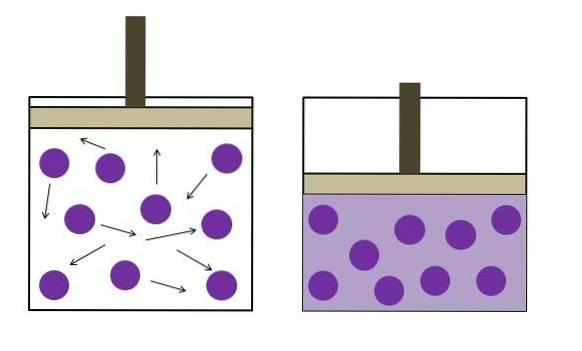
Boyles lov siger, at volumen af en ideel gas ved konstant temperatur er omvendt proportional med dens tryk; jo større beholderen er, desto lavere er trykket, som væggene oplever på grund af den samme mængde gas..
Charles Law

Charles lov siger, at volumenet af en ideel gas ved konstant tryk er direkte proportional med dens temperatur. Balloner demonstrerer Karls lov, for hvis de opvarmes, puster de lidt mere op, mens hvis de nedsænkes i flydende kvælstof, tømmes de, fordi gasvolumenet i dem trækker sig sammen..
Gay-Lussac-lov
Gay-Lussacs lov siger, at ved konstant volumen er trykket på en ideel gas direkte proportionalt med dens temperatur. Hvis en gas opvarmes gradvist i en godt lukket gryde, vil trykket inde i den være større, fordi kedlens vægge ikke deformeres eller udvides; det vil sige, dets volumen ændres ikke, det er konstant.
Avogadros lov
Endelig siger Avogadros lov, at volumen, der optages af en ideel gas, er direkte proportional med antallet af dens partikler. Således, hvis vi har en mol partikler (6.02 · 102. 3), får vi så molens volumen af gassen.
Typer af gasser
Brændbare gasser
Det er de gasser, hvis komponenter fungerer som brændstof, fordi de bruges til produktion af termisk energi. Nogle af dem er naturgas, flydende petroleumgas og brint.
Industrielle gasser
Det er de producerede gasser, der markedsføres til offentligheden til forskellige anvendelser og applikationer, såsom til sundhedssektoren, fødevarer, miljøbeskyttelse, metallurgi, kemisk industri, sikkerhedssektorer, blandt andre. Nogle af disse gasser er blandt andet oxygen, nitrogen, helium, chlor, hydrogen, carbonmonoxid, propan, methan, dinitrogenoxid..
Inerte gasser
Det er de gasser, der under specifikke temperatur- og trykforhold ikke genererer nogen kemisk reaktion eller en meget lav reaktion. De er neon, argon, helium, krypton og xenon. De bruges i kemiske processer, hvor ikke-reaktive grundstoffer er nødvendige.
Eksempler på luftformige stoffer og forbindelser
Hvad er de gasformige elementer i det periodiske system under jordforhold?
Vi har først hydrogen (H), som danner H-molekylerto. Helium (He), den letteste ædelgas, følger; og derefter nitrogen (N), oxygen (O) og fluor (F). Disse sidste tre danner også diatomiske molekyler: Nto, ELLERto og Fto.
Efter fluor kommer neon (Ne), den ædle gas, der følger helium. Under fluor har vi klor (Cl) i form af Cl-molekylerto.
Dernæst har vi resten af ædelgasserne: argon (Ar), krypton (Kr), xenon (Xe), radon (Rn) og oganeson (Og).
Derfor er de i alt tolv luftformige elementer; elleve, hvis vi udelukker den stærkt radioaktive og ustabile oganeson.
Gasformige forbindelser
Ud over gasformede elementer vil nogle almindelige gasformige forbindelser blive opført:
-HtoJa, hydrogensulfid, der er ansvarlig for lugten af rådne æg
-NH3, ammoniak, den skarpe aroma, der findes i brugte sæber
-COto, kuldioxid, en drivhusgas
-IKKEto, kvælstofdioxid
-NO, nitrogenmonoxid, en gas, der blev anset for at være meget giftig, men som spiller en vigtig rolle i kredsløbssystemet
-SW3, svovltrioxid
-C4H10, butan
-HCI, hydrogenchlorid
-ELLER3, ozon
-SF6, svovlhexafluorid
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Gassernes egenskaber. Gendannet fra: chemed.chem.purdue.edu
- Wikipedia. (2019). Gas. Gendannet fra: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (5. december 2018). Gasser - Generelle egenskaber ved gasser. Gendannet fra: thoughtco.com
- Harvard Men's Health Watch. (2019). Gasens tilstand. Gendannet fra: health.harvard.edu
- Elektronik køleredaktører. (1. september 1998). Gassernes varmeledningsevne. Gendannet fra: electronics-cooling.com



Endnu ingen kommentarer