
Lithiumbromidstruktur, egenskaber, anvendelser, risici
Det lithiumbromid det er et neutralt salt af et alkalimetal, hvis kemiske formel er LiBr. Formlen udtrykker, at dets krystallinske faste stof er sammensat af Li-ioner+ og Br- i forholdet 1: 1. Dens krystaller er hvide eller lysbeige. Det er meget opløseligt i vand, og det er også et ret hygroskopisk salt..
Denne sidste egenskab tillader dets anvendelse som tørremiddel i klimaanlæg og kølesystemer. Ligeledes blev lithiumbromid anvendt siden begyndelsen af det 20. århundrede til behandling af visse psykiske lidelser, idet dets anvendelse blev opgivet på grund af en uhensigtsmæssig brug af salt.
LiBr produceres ved behandling af lithiumcarbonat, LitoCO3, med hydrobromsyre. Efter opvarmning af mediet udfældes det ud af den vandige opløsning som et hydrat..
Dette salt irriterer huden og øjnene ved kontakt, mens det forårsager irritation af luftvejene ved indånding. Indtagelse af lithiumsalte kan forårsage kvalme, opkastning, diarré og svimmelhed.
Artikelindeks
- 1 Struktur af lithiumbromid
- 1.1 Hydrater og briller
- 2 egenskaber
- 2.1 Molekylvægt
- 2.2 Udseende
- 2.3 Lugt
- 2.4 Smeltepunkt
- 2.5 Kogepunkt
- 2.6 Opløselighed i vand
- 2.7 Opløselighed i organiske opløsningsmidler
- 2.8 Brydningsindeks (ηD)
- 2.9 Varmekapacitet
- 2.10 Standard molær entropi (Sθ 298)
- 2.11 Flammepunkt
- 2.12 Stabilitet
- 2.13 Nedbrydning
- 2,14 pH
- 2.15 Reaktivitet
- 2.16 Produktion
- 3 Nomenklatur
- 4 anvendelser
- 4.1 Tørremiddel
- 4.2 Fibre
- 4.3 Farmaceutiske produkter
- 4.4 Beroligende
- 5 risici
- 5.1 Kontakt toksicitet
- 5.2 Indtagelse
- 6 Referencer
Struktur af lithiumbromid
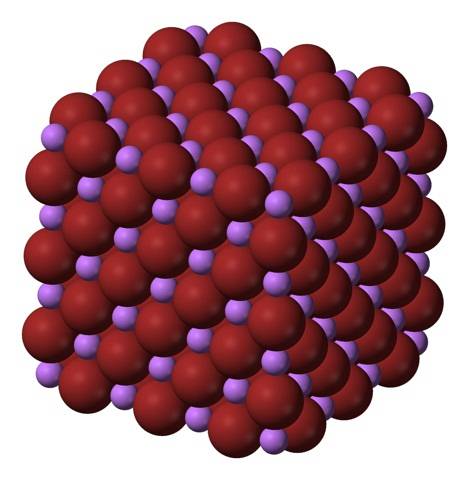
LiBr-formlen gør det klart, at Li / Br-forholdet er lig med 1; for hver Li-kation+ der skal være en br anion- modstykke. Derfor skal dette forhold holdes konstant i alle hjørner af LiBr-krystallen..
Li-ioner+ og Br- de tiltrækker hinanden og reducerer frastødningerne mellem lige store ladninger for på denne måde at stamme en kubisk krystal som perlesalt; dette er isomorft til NaCl (øverste billede). Bemærk, at i sig selv har hele sættet en kubisk geometri.
I denne krystal er Li+ de er mindre og har en lys lilla farve; mens Br- de er mere voluminøse og har en dyb brun farve. Det observeres, at hver ion har seks naboer, hvilket er det samme som at sige, at de præsenterer en oktaedrisk koordination: LiBr6 eller Li6Br; dog hvis enhedscellen overvejes, forbliver Li / Br-forholdet 1.
Dette er krystalstrukturen, der fortrinsvis er vedtaget af LiBr. Det kan dog også danne andre typer krystaller: wurzit, hvis det krystalliserer ved lave temperaturer (-50 ° C) på et substrat; eller kropscentreret kubisk eller CsCl-type, hvis den kubiske perlesaltkrystal udsættes for højt tryk.
Hydrater og briller
Det foregående gælder for vandfri LiBr. Dette salt er hygroskopisk og kan derfor absorbere fugt fra miljøet og indsætte vandmolekyler i dets egne krystaller. Således opstår hydraterne LiBrnHtoO (n = 1, 2, 3…, 10). For hvert hydrat er krystalstrukturen forskellig.
For eksempel bestemte krystallografiske undersøgelser, at LiBrHtoEller vedtage en perovskitlignende struktur.
Når disse hydrater er i vandig opløsning, kan de underkøles og forglases; det vil sige, de vedtager en tilsyneladende krystallinsk, men molekylært forstyrret struktur. Under sådanne forhold bliver hydrogenbindinger i vand ret vigtige..
Ejendomme
Molekylær vægt
88,845 g / mol.
Udseende
Hvidt eller let beige krystallinsk fast stof.
Lugt
Toilet.
Smeltepunkt
552 ºC (1.026 ºF, 825 K).
Kogepunkt
1.256 ºC (2.309 ºF, 1.538 K).
Vandopløselighed
166,7 g / 100 ml ved 20 ° C Bemærk dens høje opløselighed.
Opløselighed i organiske opløsningsmidler
Opløselig i methanol, ethanol, ether og acetone. Let opløselig i pyridin, en aromatisk forbindelse og mindre polær end de foregående.
Brydningsindeks (ηD)
1.784.
Kalorikapacitet
51,88 J / mol K.
Standard molær entropi (Sθ 298)
66,9 J / mol K.
antændelsespunkt
1.265 ° C Det betragtes som ikke-brandfarligt.
Stabilitet
Stabil. Den vandfri form er imidlertid yderst hygroskopisk.
Nedbrydning
Når det nedbrydes ved opvarmning, producerer det lithiumoxid.
pH
Mellem pH 6 og 7 i vandig opløsning (100 g / L, 20 ºC).
Reaktivitet
Lithiumbromid reagerer ikke under normale miljøforhold. Du kan dog opleve stærke reaktioner med stærke syrer, når temperaturen stiger..
Ved opløsning i vand er der en stigning i temperaturen forårsaget af en negativ hydratiserende entalpi.
Produktion
LiBr fremstilles ved omsætning af lithiumhydroxid eller lithiumcarbonat med brombrintesyre i en neutraliseringsreaktion:
LitoCO3 + HBr => LiBr + COto + HtoELLER
Lithiumbromid opnås som et hydrat. For at opnå den vandfri form er det nødvendigt at opvarme det hydratiserede salt under vakuum..
Nomenklatur
Navnet 'lithiumbromid' stammer fra det faktum, at det er et metalhalogenid, der er navngivet i henhold til stamnomenklaturen. Andre navne, lige så gyldige, men mindre anvendte, er lithiummonobromid i henhold til den systematiske nomenklatur; og lithisk bromid (den unikke valens på +1 for lithium) ifølge den traditionelle nomenklatur.
Ansøgninger
Tørremiddel
LiBr er et hygroskopisk salt, der danner en koncentreret saltlage, der er i stand til at absorbere fugt fra luften over en lang række temperaturer. Denne saltlage anvendes som tørremiddel i klimaanlæg og kølesystemer..
Fibre
Det bruges til at øge volumen af uld, hår og andre organiske fibre.
Farmaceutiske produkter
LiBr danner addukter med nogle farmaceutiske forbindelser, der modulerer deres virkning. Et addukt er kombinationen ved koordinering af to eller flere molekyler uden at frembringe en strukturel ændring af nogen af de sammenføjede molekyler.
Beroligende middel
Lithiumbromid blev først brugt som beroligende middel ved visse psykiske lidelser, og det blev afbrudt i 1940. I øjeblikket anvendes lithiumcarbonat; men under alle omstændigheder er lithium det element, der udøver den terapeutiske virkning i begge forbindelser.
Lithium anvendes til behandling af bipolar lidelse, idet det har været nyttigt til kontrol af maniske episoder af lidelsen. Litium menes at hæmme aktiviteten af exciterende neurotransmittere, såsom dopamin og glutaminsyre.
På den anden side øger det aktiviteten af det hæmmende system medieret af neurotransmitteren gamma-amino-smørsyre (GABA). Disse handlinger kunne udgøre en del af grundlaget for den terapeutiske virkning af lithium.
Risici
Kontakt toksicitet
Hudirritation og sensibilisering, allergier. Alvorlig øjenskade eller irritation i øjnene, luftvejene, næsepassager og hals.
Indtagelse
De vigtigste symptomer på grund af indtagelse af lithiumbromid er: gastrointestinale lidelser, opkastning og kvalme. Andre negative virkninger af indtagelse af salt inkluderer agitation, spasmer og bevidsthedstab..
Tilstanden kendt som "bromisme" kan forekomme med lithiumbromiddoser større end 225 mg / dag..
Nogle af følgende tegn og symptomer kan forekomme i vittigheder: forværring af acne og appetitløshed, rysten, taleproblemer, apati, svaghed og manisk agitation.
Referencer
- Kemisk formulering. (2019). Lithiumbromid. Gendannet fra: formulacionquimica.com
- David C. Johnson. (10. juli 2008). Ny ordre på lithiumbromid. Natur. doi.org/10.1038/454174a
- Aayushi Jain & R.C. Dixit. (s.f.). Strukturel faseovergang i lithiumbromid: virkning af tryk og temperatur. [PDF]. Gendannet fra: ncpcm.in
- Takamuku et al. (1997). Røntgendiffraktionsundersøgelser af superkølet vandig lithiumbromid og lithiumiodidopløsninger. Institut for Kemi, Det Naturvidenskabelige Fakultet, Fukuoka University, Nanakuma, Jonan-ku, Fukuoka 814-80, Japan.
- National Center for Biotechnology Information. (2019). Lithiumbromid. PubChem-database, CID = 82050. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Lithiumbromid. Gendannet fra: en.wikipedia.org
- Royal Society of Chemistry. (2019). Lithiumbromid. Chemspider. Gendannet fra: chemspider.com

Endnu ingen kommentarer