
Atomradius, hvordan det måles, hvordan det ændres og eksempler
Det atomradio det er en vigtig parameter for de periodiske egenskaber for elementerne i det periodiske system. Det er direkte relateret til atomernes størrelse, da jo større radius, jo større eller mere voluminøs er de. Ligeledes er det relateret til deres elektroniske egenskaber..
Jo flere elektroner et atom har, jo større er dets atomstørrelse og radius. Begge er defineret af elektronerne fra valensskallen, for sandsynligheden for at finde en elektron nærmer sig nul ved afstande ud over deres baner. Det modsatte sker i nærheden af kernen: sandsynligheden for at finde en elektron øges.

Det øverste billede repræsenterer en pakning af vatkugler. Bemærk, at hver enkelt er omgivet af seks naboer, medregner ikke en anden mulig øvre eller nedre række. Den måde, hvorpå bomuldskuglerne komprimeres, vil definere deres størrelser og derfor deres radier; ligesom atomer.
Elementerne i henhold til deres kemiske natur interagerer med deres egne atomer på en eller anden måde. Derfor varierer atomradiusens størrelse alt efter typen af binding og den faste pakning af dens atomer..
Artikelindeks
- 1 Hvordan måles atomradius?
- 1.1 Bestemmelse af den internukleare afstand
- 1.2 Enheder
- 2 Hvordan ændrer det sig i det periodiske system?
- 2.1 Over en periode
- 2.2 Faldende gennem en gruppe
- 2.3 Lanthanid sammentrækning
- 3 eksempler
- 4 Referencer
Hvordan måler du atomradius?
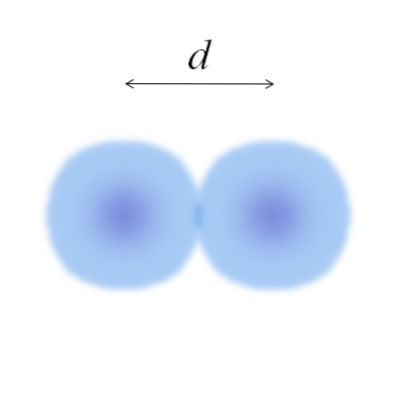
I hovedbilledet kan det være let at måle bomuldskuglernes diameter og derefter dele den med to. Imidlertid er sfæren af et atom ikke fuldt defineret. Hvorfor? Fordi elektroner cirkulerer og diffunderer i bestemte områder af rummet: orbitaler.
Derfor kan atomet betragtes som en kugle med uimplerbare kanter, hvilket det er umuligt at sige med sikkerhed, hvor langt de ender. For eksempel viser midten af området tæt på kernen i billedet ovenfor en mere intens farve, mens dens kanter er slørede..
Billedet repræsenterer et diatomisk molekyle E.to (som Clto, Hto, ELLERto, etc.). Antages det, at atomerne er sfæriske legemer, hvis afstanden blev bestemt d der adskiller begge kerner i den kovalente binding, ville det være tilstrækkeligt at opdele det i to halvdele (d/ 2) for at opnå atomradius; mere præcist, den kovalente radius fra E til E.to.
Hvad hvis E ikke dannede kovalente bindinger med sig selv, men var et metalelement? Derefter d det ville være angivet med antallet af naboer, der omgiver E i dets metalliske struktur; det vil sige ved koordinationsnummeret (N.C) for atomet inde i emballagen (husk bomuldskuglerne i hovedbilledet).
Bestemmelse af den internukleare afstand
At bestemme d, som er den indre kerneafstand for to atomer i et molekyle eller en emballage, kræves fysiske analyseteknikker.
En af de mest anvendte er røntgendiffraktion. I den bestråles en lysstråle gennem en krystal, og diffraktionsmønsteret som følge af interaktionerne mellem elektroner og elektromagnetisk stråling undersøges. Afhængig af pakningen kan forskellige diffraktionsmønstre opnås og derfor andre værdier på d.
Hvis atomerne er "stramme" i krystalgitteret, vil de præsentere forskellige værdier af d sammenlignet med hvad de ville have, hvis de var "komfortable". Ligeledes kunne disse internukleare afstande svinge i værdier, så atomradiusen består faktisk af en gennemsnitsværdi af sådanne målinger..
Hvordan er atomradius og koordinationsnummer relateret? V. Goldschmidt etablerede et forhold mellem de to, hvor den relative værdi for en N.C på 12 er 1; 0,97 for en pakning, hvor atomet har N.C lig med 8; 0,96, for en N.C lig med 6; og 0,88 for en N.C på 4.
Enheder
Fra værdierne for N.C lig med 12 er mange af tabellerne konstrueret, hvor atomradierne for alle elementerne i det periodiske system sammenlignes.
Da ikke alle grundstoffer danner sådanne kompakte strukturer (N.C mindre end 12), bruges V. Goldschmidt-forholdet til at beregne deres atomare radier og udtrykke dem til samme pakning. På denne måde er målingerne af atomradierne standardiserede..
Men i hvilke enheder udtrykkes de? På grund af d er af meget lille størrelse, skal vi ty til angstromsenhederne Å (10 ∙ 10-10m) eller også meget brugt, picometeret (10 ∙ 10-12m).
Hvordan ændrer det sig i det periodiske system?
Over en periode
De atomare radier, der er bestemt for metalelementer, kaldes metalliske radier, mens for ikke-metalliske elementer er kovalente radier (såsom fosfor, P4, eller svovl, S8). Imidlertid er der mellem de to typer eger en mere fremtrædende skelnen end navnet.
Fra venstre mod højre i samme periode tilføjer kernen protoner og elektroner, men sidstnævnte er begrænset til det samme energiniveau (hovedkvantetal). Som en konsekvens udøver kernen en stigende effektiv nuklear ladning på valenselektronerne, som kontraherer atomradien..
På denne måde har ikke-metalliske elementer i samme periode tendens til at have mindre atomare (kovalente) radier end metaller (metalliske radier).
Faldende gennem en gruppe
Når du kommer ned gennem en gruppe, aktiveres nye energiniveauer, som giver elektronerne mere plads. Således dækker den elektroniske sky større afstande, dens slørede periferi ender med at bevæge sig længere væk fra kernen, og derfor udvides atomradius..
Lanthanid sammentrækning
Elektronerne i den indre skal hjælper med at beskytte den effektive nukleare ladning på valenselektronerne. Når de orbitaler, der udgør de indre lag, har mange “huller” (noder), som det sker med f orbitalerne, trækker kernen kraftigt atomradius på grund af deres dårlige beskyttelseseffekt..
Denne kendsgerning fremgår af lanthanidkontraktionen i periode 6 i det periodiske system. Fra La til Hf er der en betydelig sammentrækning af atomradius som et resultat af f-orbitalerne, som "fyldes op", når f-blokken krydses: den af lanthanoiderne og actinoiderne.
En lignende effekt kan også observeres med elementerne i blok p fra periode 4. Denne gang, produkt af den svage afskærmningseffekt af de orbitaler, der fyldes op, når de passerer overgangsmetalperioderne.
Eksempler
I periode 2 i det periodiske system er atomradierne for dets elementer:
-Li: 257 pm
-Vær: kl
-B: 88 pm
-C: kl
-N: 74 pm
-Eller: kl
-F: 64 pm
Bemærk, at lithiummetal har den største atomradius (257 pm), mens fluor, der er placeret yderst til højre i perioden, er den mindste af dem alle (64 pm). Atomradien falder ned fra venstre mod højre i samme periode, og de anførte værdier viser det.
Når lithium danner metalliske bindinger, er dets radius metallisk; og fluor, da det danner kovalente bindinger (F-F), er dets radius kovalent.
Hvad hvis du vil udtrykke atomradierne i enheder af angstrøm? Del dem blot med 100: (257/100) = 2,57Å. Og så videre med resten af værdierne.
Referencer
- Kemi 301. Atomic Radii. Gendannet fra: ch301.cm.utexas.edu
- CK-12 Foundation. (28. juni 2016). Atomic Radius. Gendannet fra: chem.libretexts.org
- Tendenser i Atomic Radii. Hentet fra: intro.chem.okstate.edu
- Clackamas Community College. (2002). Atomisk størrelse. Gendannet fra: dl.clackamas.edu
- Clark J. (august 2012). Atomisk og ionisk radius. Gendannet fra: chemguide.co.uk
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave., S. 23, 24, 80, 169). Mc Graw Hill.



Endnu ingen kommentarer