
Natriumbromid (NaBr) struktur, egenskaber og anvendelser
Det natriumbromid det er en kemisk art, der hører til saltene af uorganisk oprindelse. Dens struktur er sammensat af halogenbrom og det metalliske element natrium i forholdet 1: 1. Dens kemiske formel er NaBr, og den er i fast sammenlægningstilstand under standard temperatur- og trykforhold (25 ° C og 1 atm).
Normalt kan det ses som et hvidt pulver, og det betragtes som en krystallinsk type forbindelse, der også udviser hygroskopisk opførsel; det vil sige, det har evnen til at absorbere fugt fra omgivelserne.

Tilsvarende har natriumbromid fysiske egenskaber, der ligner en anden ionforbindelse af det samme metal: natriumchlorid. Dette chlorid er repræsenteret som NaCl, som er mere almindeligt kendt som almindeligt salt eller bordsalt..
Det har et stort antal anvendelser inden for forskellige videnskabelige områder; For eksempel anvendes det til produktion af forskellige lægemidler (beroligende midler, hypnotika, antikonvulsiva, blandt andre) såvel som i organiske synteser og endda i fotograferingsapplikationer..
Artikelindeks
- 1 Kemisk struktur
- 1.1 Kemisk syntese
- 2 egenskaber
- 3 anvendelser
- 4 Referencer
Kemisk struktur
Som tidligere nævnt forekommer natriumbromid i den faste fase og har ligesom mange andre salte af uorganisk karakter en krystallinsk strukturel konformation..
Dette krystallinske molekyle, der består af et brom og et hydrogenatom, har en ansigtscentreret kubisk konformation, såsom halogenid-salte af det samme metal (NaI, NaF og NaCl).
Dette molekylære arrangement danner det strukturelle grundlag for mange forbindelser, hvor ordren udføres på en sådan måde, at hver ion forbliver i midten af en oktaedrisk figur, som vist i det følgende billede.
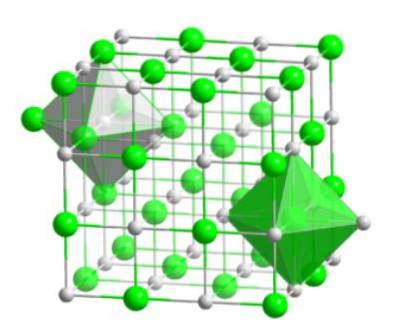
I denne type krystal kan man se, hvordan hver af ionerne har omkring sig seks andre ioner - som har en modsat elektrisk ladning - som er placeret i enderne af den oktaedriske figur..
Ligeledes indebærer strukturen af dette ioniske stof, at det har et højt smeltepunkt på ca. 747 ° C, der findes kommercielt i dets to former: en vandfri art (uden vandmolekyler) og en dihydratiseret art (med to vandmolekyler i dens struktur formel (NaBr 2HtoO)), hvis smeltepunkter er forskellige.
Kemisk syntese
Natriumbromid stammer fra den kemiske reaktion, der finder sted mellem hydrogenbromid (BrH, et hydrogenhalogenid i gasfasen) og natriumhydroxid (NaOH, en stærk base i fast fase og med hygroskopiske egenskaber).
På denne måde fremstilles det kommercielt ved tilsætning af et overskud af brom til en NaOH-opløsning. Således dannes en bromid / bromblanding. Derefter underkastes de resulterende produkter fordampning, indtil de er tørre, og de behandles med kulstof til dannelse af bromationreduktionsreaktionen (BrO3-til bromidionen (Br-).
Neutralisering
Tilsvarende kan dette uorganiske salt også produceres gennem en neutraliseringsreaktion af natriumcarbonat (NatoCO3) med bromsyre (HBrO3ved at følge den samme procedure som beskrevet ovenfor.
Gennem en syntese er det muligt at producere dette stof gennem reaktionen mellem jern med brom og vand. Som et produkt af denne reaktion stammer jernholdige jernbromidarter.
Senere dannede denne art (repræsenteret som FeBrto/ FeBr3) opløses i vand, og der tilsættes en vis mængde natriumcarbonat. Endelig filtreres opløsningen og passerer gennem en fordampningsproces for endelig at opnå natriumbromidet..
Ejendomme
- Det findes almindeligvis i fast sammenlægningstilstand i form af et hvidt pulver.
- Den har en krystallinsk struktur med et terningformet molekylært arrangement centreret på ansigterne.
- Smeltepunktet for dette stof er ca. 747 ° C for dets vandfri form og 36 ° C for dets dihydratform, hvilket udgør nedbrydning inden smeltning..
- Den består af en natriumion (Na+og en bromidion (Br-), med en molær masse eller molekylvægt på 102,89 g / mol.
- Dens kogepunkt er ret højt, observeret ved 1390 ° C (svarende til 2530 ° F eller 1660 K).
- Opløseligheden af denne art er omkring 94,32 g / 100 ml i vand ved 25 ° C, stigende med stigende temperatur..
- Når det opvarmes til det punkt, hvor det nedbrydes, frigiver dette stof brom- og natriumoxidgasser, der betragtes som giftige..
- Densiteten af den vandfri form af natriumbromid er 3,21 g / cm33, mens dihydratforbindelsen er 2,18 g / cm3.
- Dens opløselighed i alkohol betragtes som moderat som i andre opløsningsmidler, såsom pyridin, ammoniak og hydrazin.
- Præsenterer uopløselighed mod acetonitril og acetone.
Ansøgninger
- I medicin bruges det som et lægemiddel til et stort antal tilstande, der forårsager anfald, og som en terapi til forebyggelse af epilepsi hos patienter med Wolf-Hirschhorn syndrom såvel som i beroligende og hypnotiske behandlinger..
- Inden for veterinærmedicin bruges det til hunde, der har anfaldsforstyrrelser på grund af bivirkninger af lægemidler som primidon eller phenobarbital.
- Inden for olieindustrien anvendes det i fremstillingsprocesserne for visse væsker med varierende densitet, der anvendes i oliebrønde..
- Inden for biologisk forskning er dets mikrobiocide egenskaber blevet bevist; det vil sige, det bruges til at kontrollere udviklingen af forskellige typer bakterier.
- I visse synteser af organisk type anvendes dette uorganiske salt til fremstilling af andre arter bestående af brom. F.eks. Opnås ved hjælp af Finkelstein-reaktionen visse højere reaktivitetsalkylhalogenider, hvoraf den ene tidligere blev brugt i vid udstrækning til fotografering..
- I rengørings- og desinfektionsområdet anvendes natriumbromid i kombination med klor til sanitet af store mængder vand, såsom i svømmebassiner og boblebad..
Referencer
- Wikipedia. (s.f.). Natriumbromid. Gendannet fra en.wikipedia.org
- PubChem. (s.f.). Natriumbromid. Hentet fra pubchem.ncbi.nlm.nih.gov
- Johnson, A. W. (1999). Invitation til organisk kemi. Gendannet fra books.google.co.ve
- Science Direct. (s.f.). Natriumbromid. Hentet fra sciencedirect.com
- Riviere, J. E. og Papich, M. G. (2009). Veterinær farmakologi og terapi. Gendannet fra books.google.co.ve

Endnu ingen kommentarer