
Latent varme

Hvad er latent varme?
Latent varme er den mængde varme, som et stof har brug for at absorbere eller frigive for at ændre dets fysiske tilstand eller fase, idet temperaturen holdes konstant under denne proces. Den tilførte eller frigivne varme manifesterer sig ikke, den "føles" ikke som sædvanlig i en temperaturvariation; deraf udtrykket latent varme.
Det latente ord kommer fra det latinske ord "latens", hvilket betyder skjult, så latent varme opfører sig som om det ikke eksisterede, da temperaturen blev holdt konstant. Men det eksisterer: hvad der sker er, at det forbruges totalt i faseændring eller fysisk tilstand.
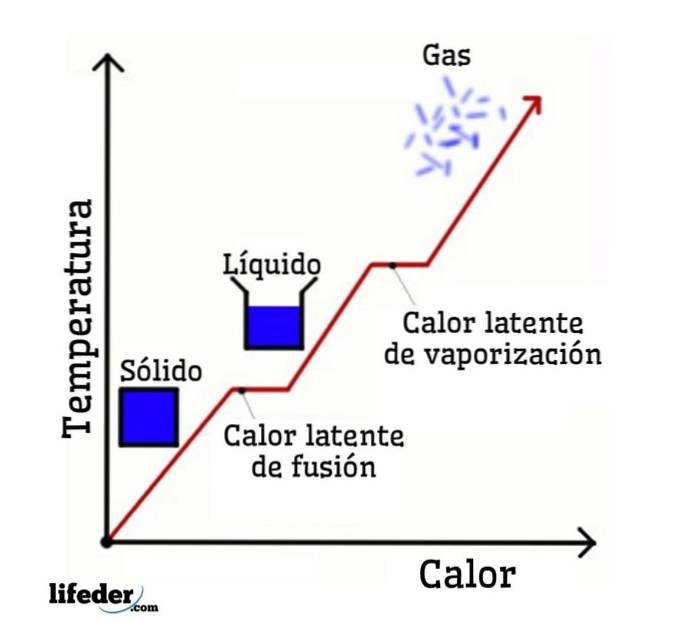
Når man tager vand som et eksempel, er faseændringerne som følger: is (faststof) smelter i flydende vand (væske) i en proces kaldet smeltning; og flydende vand fordamper igen og omdannes til vanddamp (gas) i en proces kaldet fordampning.
På den anden side afkøles vanddamp til flydende vand i en proces, der kaldes kondens; og flydende vand vender tilbage til is i en proces kaldet størkning.
Hver af disse faseændringer er forbundet med en latent varme, som kan være positiv (absorption) eller negativ (frigivelse)..
Latent fusionsvarme

Det er den mængde varme, der skal tilføres til en given mængde fast stof for at ændre dets fysiske tilstand fra fast til væske. Under fusion er der ingen temperaturændring, så mens det faste stof smelter eller smelter, har væsken, der genereres fra det, den samme temperatur som hele det faste stof.
Generelt bestemmes denne varme ved det normale smeltepunkt, som er den temperatur, ved hvilken det faste stof begynder at smelte under atmosfærisk tryk. Ved denne temperatur er der ligevægt eller samtidig tilstedeværelse af fast tilstand og flydende tilstand på samme tid..
Den faste tilstand er kendetegnet ved tilstedeværelsen af en kompakt struktur på grund af eksistensen af højenergiske kemiske bindinger, som giver den strukturel stivhed. Til omdannelsen af et fast stof til en væske skal disse interaktioner brydes, så energi forbruges (absorberes) til det formål.
Et typisk eksempel er, når en is forbruges, der består af vand, sukker og andre stoffer. Det er almindeligt at observere, at is, hvis den ikke indtages hurtigt, begynder at smelte, det vil sige at smelte. Dette sker, når isens temperatur når isens smeltepunkt..
Eksempler
Nogle eksempler på latente fusionsvarmer udtrykt i J / g vil blive anført; det vil sige den energi, som et gram fast stof skal absorbere for at smelte ved smeltepunktet:
-Ice 334.0
-Aluminium 380.0
-Svovl 38,1
-Kobber 134.0
-Ethanol 104,0
-Kviksølv 11.8
-Guld 64,5
-Sølv 80.3
-Bly 24.5
-Wolfram 184
Is absorberer meget varme, ikke fordi dens interaktioner er stærkere, men fordi den i undtagelse er i stand til at sprede varmen mellem dens krystaller..
Latent fordampningsvarme
Det er den mængde varme, som en given mængde stof absorberer for at skifte fra flydende tilstand til gasform ved det normale kogepunkt. Det vil sige, det er varmen, som væsken absorberer, når den koger og bliver til gas uden en temperaturforøgelse..
Inden for væsken kan stoffernes molekyler interagere ved dannelse af hydrogenbindinger og ved tiltrækningskræfter mellem molekylerne. For at overføre et stof fra flydende tilstand til gasform, skal disse kræfter overvindes, så varme skal tilføres.
Sensibel varme er, hvad væsken kun absorberer for at øge temperaturen, hvilket afhænger af dens specifikke varme. I mellemtiden bruges den latente fordampningsvarme til at omdanne den direkte til damp, en proces, der er meget lettere ved kogepunktet..
Eksempler
Nedenfor er eksempler på nogle væsker med deres respektive latente fordampningsopvarmning udtrykt igen i J / g:
-Eddikesyre 402
-Aceton 518
-Vand 2256
-Ethylalkohol 846
-Svovl 1510
-Benzen 390
-Kuldioxid 574
-Klor 293
-Ether 377
-Glycerin 974
-Kviksølv 295
-Oxygen 214
Bemærk den enorme latente varme af flydende vand: 1 g flydende vand (ca. 1 ml) har brug for at absorbere 2256 J for at fordampe. Flydende vand spreder den varme, den modtager, endnu bedre i forhold til is.
Latent størkningsvarme
Det er varmen, som en bestemt mængde stof skal afgive for at gå fra dets flydende tilstand til dets faste tilstand ved størkning eller frysningspunktet. Igen, indtil væsken er størknet fuldstændigt, forbliver temperaturen konstant..
Størringsprocessen er det modsatte af fusionsprocessen, så værdierne for den latente størkningsvarme og de for den latente fusionsvarme er de samme, men med modsatte tegn..
Molekylerne i et stof i flydende tilstand bevæger sig med en vis frihed på grund af den energi, de besidder. For at passere til den faste fase skal molekylerne derfor frigive energi i form af varme, hvilket muliggør større interaktion mellem stoffets molekyler..
Interaktionen mellem molekylerne favoriserer dannelsen af de kemiske bindinger i den faste fase. Et eksempel på dette sker, når flydende vand placeres i de isdannende beholdere i køleskabens fryser. Fryseren ekstraherer varme fra det flydende vand, og den størkner til at blive is.
Eksempler
Nogle eksempler på latente stivningsvarme (i J / g) for nogle væsker er anført nedenfor:
-Vand (-334)
-Aluminium (-380)
-Svovl (-38)
-Kobber (-134)
-Ethanol (-104)
Latent kondensvarme
Det er den mængde varme, der skal afgives eller frigøres fra en bestemt mængde stof for at gå fra gasformig tilstand til flydende tilstand. Gassen, der kondenserer, og den dannede væske opretholder den samme temperatur under kondens.
Kondens er det modsatte af fordampning. Den latente kondensvarme har den samme værdi som den latente fordampningsvarme, men med det modsatte tegn og ved kogepunktet. Et eksempel på dette er, når madlavning og damp kondenserer på indersiden af gryderne..
Gasformige molekyler bevæger sig frit drevet af den energi, de besidder. Derfor skal de frigive energi for at tillade intermolekylære interaktioner mellem den flydende tilstand at etablere sig mellem stoffets molekyler..
I naturen er der mange andre eksempler på fænomenet vandkondensation. Vanddamp stiger i atmosfæren og kondenserer i skyerne i form af vanddråber.
Tilstedeværelsen af vanddråber i bilvinduer observeres også som et resultat af kondensering af vand på grund af et temperaturfald, der opstår tidligt om morgenen, der udgør den såkaldte dug.
Eksempler
Endelig, for nogle dampe vil deres respektive latente kondensopvarmning udtrykt igen i J / g blive opført:
-Eddikesyre (-402)
-Aceton (-518)
-Vand (-2256)
-Ethylalkohol (-846)
-Svovl (-1510)
-Benzen (-390)
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Walter J. Moore. (1963). Fysisk kemi. I kemisk kinetik. Fjerde udgave, Longmans.
- Wikipedia. (2020). Latent varme. Gendannet fra: en.wikipedia.org
- Redaktørerne af Encyclopaedia Britannica. (2020). Latent varme. Gendannet fra: britannica.com
- Ingeniørværktøjskasse. (2003). Væsker: Latent fordampningsvarme. Gendannet fra: engineeringtoolbox.com
- Lumenindlæring. (s.f.). Faseændring og latent varme. Gendannet fra: courses.lumenlearning.com



Endnu ingen kommentarer