
Dimethylamin ((CH3) 2NH) struktur, egenskaber, anvendelser, risici

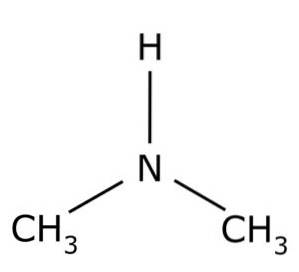
Det dimethylamin er en organisk forbindelse dannet af to methylgrupper -CH3 knyttet til en -NH-gruppe. Dens kemiske formel er (CH3)toNH. Det er en farveløs gas. Når det er i luften ved lave koncentrationer, opfattes en fiskeagtig lugt. Men hvis det er i høj koncentration, har det lugten af ammoniak NH3.
Dimethylamin er til stede i planter og dyr. Det menes, at det hos mennesker kommer fra nedbrydningen af visse enzymer, men også fra indtagelse af nogle fødevarer såsom fisk. Hvis dimethylamingas opløses i vand, danner den meget basiske og ætsende opløsninger.
Det har forskellige industrielle anvendelser, såsom at producere opløsningsmidler, at fremskynde vulkaniseringen af gummi, at hæmme korrosion af rør, at fremstille sæber, at forberede farvestoffer og at absorbere sure gasser i visse processer..
Dimethylamin er en meget brandfarlig gas. Beholdere må ikke udsættes for varme eller ild, da de kan eksplodere. Derudover er dens dampe irriterende for øjnene, huden og luftvejene..
Det er en forbindelse, der kan være en del af atmosfæriske aerosoler, det vil sige meget fine dråber, der findes i atmosfæren.
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Kogepunkt
- 3.5 Flammepunkt
- 3.6 Selvantændelsestemperatur
- 3.7 Densitet
- 3.8 Opløselighed
- 3,9 pH
- 3.10 Dissociationskonstant
- 3.11 Kemiske egenskaber
- 3.12 Andre egenskaber
- 3.13 Biokemiske reaktioner
- 4 Opnåelse
- 5 Tilstedeværelse i naturen
- 5.1 Patienter med overskydende dimethylamin
- 6 anvendelser
- 7 risici
- 8 Indflydelse af DMA på atmosfæren
- 9 Referencer
Struktur
Dimethylamin er en sekundær alifatisk amin. Dette betyder, at nitrogensubstituenterne (N) er alifatiske (-CH3), hvilket betyder, at de ikke er aromatiske, og at de er to. Derfor er de to methyl-CH3 bundet til kvælstof, som også har et hydrogen (H).
I dimethylaminmolekylet har nitrogen (N) et par frie elektroner, det vil sige et par elektroner, der ikke er bundet til noget andet atom..
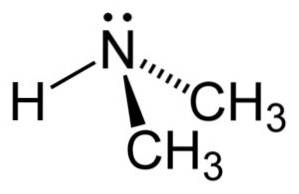
Nomenklatur
- Dimethylamin
- N, N-dimethylamin
- N-methylmethanamin
- DMA (akronym for di-methylamin).
Ejendomme
Fysisk tilstand
Farveløs gas.
Molekylær vægt
45,08 g / mol
Smeltepunkt
-93 ºC
Kogepunkt
7,3 ºC
Flashpoint
-6,69 ºC (lukket kopmetode).
Selvantændelsestemperatur
400 ° C
Massefylde
Væske = 0,6804 g / cm3 ved 0 ºC.
Damp = 1,6 (relativ tæthed i forhold til luft, luft = 1).
Opløselighed
Meget opløselig i vand: 163 g / 100 g vand ved 40 ° C. Opløselig i ethanol og ethylether.
pH
Vandige dimethylaminopløsninger er stærkt basiske.
Dissociation konstant
Kb = 5,4 x 10-4
pKtil konjugeret syre = 10,732 ved 25 ° C Den konjugerede syre er dimethylammoniumionen: (CH3) NHto+
Kemiske egenskaber
Flydende dimethylamin kan angribe plast, gummi og belægning.
Når det opløses i vand, tager kvælstofs frie elektronpar (N) en proton (H+) fra vandet, hvilket efterlader en OH fri-, så det danner meget basiske og ætsende opløsninger:
Dimethylamin + vand → Dimethylammoniumion + hydroxylion
(CH3)toNH + HtoO → (CH3)toNHto+ + Åh-
Med salpetersyre får du et nitratsalt, det vil sige dimethylammoniumnitrat:
Dimethylamin + salpetersyre → Dimethylammoniumnitrat
(CH3)toNH + HNO3 → (CH3)toNHto+IKKE3-
Andre egenskaber
Når den er i lav koncentration i luften, har den en fisklignende lugt, mens den i høje koncentrationer lugter af ammoniak (NH3).
Biokemiske reaktioner
I kroppen kan dimethylamin undergå nitrosering under svagt sure betingelser for at give dimethylnitrosamin en kræftfremkaldende forbindelse (CH2).3)toN-NEJ.
Dannelsen af dimethylnitrosamin forekommer fra dimethylamin og nitrit (natriumnitrit) i maven (ved pH 5-6) ved indvirkning af bakterier i mave-tarmkanalen. Natriumnitrit er til stede i nogle fødevarer.
Dimethylamin + Natriumnitrit → Dimethylnitrosamin + Natriumhydroxid
(CH3)toNH + NaNOto → (CH3)toN-NO + NaOH
Opnåelse
Dimethylamin fremstilles kommercielt ved omsætning af methanol (CH3OH) med ammoniak (NH3ved 350-450 ° C i nærvær af en silica-aluminiumoxid-katalysator (SiOto/TiltoELLER3).
2 CH3OH + NH3 → (CH3)toNH + 2 HtoELLER
Da monomethylamin og trimethylamin også produceres, udføres oprensning i en serie på fire til fem destillationskolonner..
Tilstedeværelse i naturen
Dimethylamin findes i planter og dyr. Det findes også naturligt og rigeligt i human urin.
Det anslås, at dets tilstedeværelse hos mennesker skyldes, at den produceres af visse typer tarmbakterier fra nogle forbindelser, der findes i mad.
Nogle af disse forbindelser er cholin (en forbindelse, der er forbundet med gruppen af B-vitaminer) og trimethylaminoxid. Det menes også at komme fra et enzym, der hæmmer nitrogenoxid (NO), der dannes i kroppen..
Visse informationskilder indikerer, at stigningen i dimethylamin i urinen skyldes indtagelse af fisk og skaldyr, hvor de højeste værdier opnås, når blæksprutte, kulmule, sardiner, sværdfisk, torsk, hvilling og stråle spises..

Patienter med overskydende dimethylamin
Dimethylamin anses for at være et uræmisk toksin, det vil sige et stof, der kan forårsage skade, hvis dets koncentration i urinen er for høj. Faktisk er der observeret meget høje niveauer af dimethylamin hos patienter med nyresygdom i slutstadiet..
Det menes, at der hos disse patienter kan være en overbefolkning af tarmbakterier, der kunne producere den.
Ansøgninger
Dimethylamin eller DMA bruges til at:
- Fremstilling af andre forbindelser.
- Fremstilling af opløsningsmidlerne dimethylformamid og dimethylacetamid.
- Fremskynd vulkaniseringen af visse gummier.
- Fjern hår fra huderne under garvning.
- Handle som en antioxidant til opløsningsmidler.
- Serveres som et mineral flotationsmiddel.
- Hæmmer korrosion og som et antifouling middel til rør.
- Fungerer som et overfladeaktivt middel.
- Lav sæber og rengøringsmidler.
- Handle som tekstilkemiker.
- Fungerer som et antiknockmiddel i brændstoffer og som en stabilisator for benzin.
- Forbered farvestoffer.
- Absorber syre gasser.
- Serveres som drivmiddel til pesticider og raketter.
- Vær en del af midlerne til vandbehandling.
- Fungerer som et fungicid i landbrugskemiske produkter.
- Ophørte anvendelser såsom at tiltrække og dræbe snegle eller insekter, der angriber bomuld.


Risici
Dimethylamin-dampe irriterer huden, øjnene og luftvejene..
Hvis det kommer i kontakt med huden i flydende form, kan det forårsage forfrysninger og kemiske forbrændinger. Dens indånding har skadelige helbredseffekter.
DMA-gas er ætsende og kan danne ætsende vandige opløsninger. Dine vandige opløsninger kan blive brandfarlige, medmindre de er godt fortyndet..
Dimethylamin i gasform antændes let og producerer giftige dampe af nitrogenoxider (NOx).
Hvis beholderen med denne gas udsættes for ild eller intens varme, kan den eksplodere..
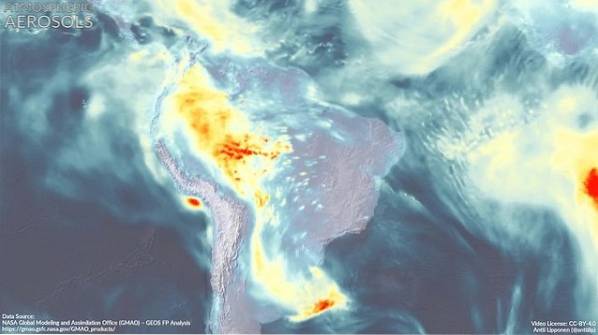
Indflydelse af DMA på atmosfæren
Den atmosfæriske aerosol (meget små dråber af blandinger af naturlige forbindelser og / eller forurenende stoffer i atmosfæren) har en dybtgående indvirkning på det globale klima og på luftkvaliteten i de forskellige regioner i verden..
Dannelsen af de nye aerosolpartikler er endnu ikke helt forstået.
Det anslås, at dimethylamin deltager sammen med andre forbindelser i dannelsen af disse partikler, hvilket synes at afhænge af, at der er stærke emissioner af DMA i området..
For eksempel er der i industriområder en højere koncentration end i landbrugsområder, og dette kan påvirke den måde, som WFD deltager på..
Det er bemærkelsesværdigt, at ifølge nogle forskere kan afbrænding af plantemateriale indeholdende glyphosat (et af de mest anvendte herbicider i verden) føre til dannelse af dimethylamin.
Referencer
- OS. National Library of Medicine. (2019). Dimethylamin. Gendannet fra pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fjerde udgave. John Wiley & Sons.
- Morrison, R.T. og Boyd, R.N. (2002). Organisk kemi. 6. udgave. Prentice-Hall.
- Windholz, M. et al. (redaktører) (1983). Merck-indekset. En encyklopædi over kemikalier, lægemidler og biologiske stoffer. Tiende udgave. Merck & CO., Inc..
- Abramowitz, M.K. et al. (2010). Patofysiologien af uræmi. Alifatiske aminer. I kronisk nyresygdom, dialyse og transplantation (tredje udgave). Gendannet fra sciencedirect.com.
- Li, H. et al. (2019). Indflydelse af atmosfæriske forhold på svovlsyre-dimethylamin-ammoniakbaseret ny partikeldannelse. Kemosfære 2019; 245: 125554. Gendannet fra ncbi.nlm.nih.gov.
- Mackie, J.C. og Kennedy, E.M. (2019). Pyrolyse af glyphosat og dets giftige produkter. Miljø. Sci. Technol. 2019: 53 (23): 13742-13747. Gendannet fra ncbi.nlm.nih.gov.


Endnu ingen kommentarer