
Aluminiumcarbonatstruktur, egenskaber, anvendelser

Det aluminiumcarbonat er et uorganisk salt, hvis kemiske formel er Alto(CO3)3. Det er et praktisk taget ikke-eksisterende metallisk carbonat i betragtning af dets høje ustabilitet under normale forhold..
Blandt årsagerne til dets ustabilitet kan vi nævne de svage elektrostatiske interaktioner mellem Al-ioner3+ og CO3to-, hvilket i teorien skulle være meget stærkt på grund af størrelsen af deres ladninger.
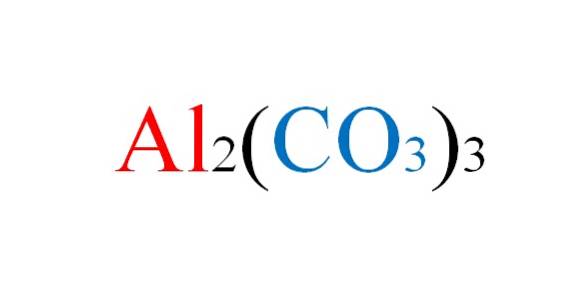
Salt oplever ingen ulemper på papiret, når de kemiske ligninger af dets reaktioner skrives; men i praksis vender det mod ham.
På trods af hvad der er blevet sagt, kan aluminiumcarbonat forekomme i selskab med andre ioner, som det sker med mineralet dawsonite. Der er også et derivat, hvor det interagerer med vandig ammoniak. For resten betragtes det som en blanding mellem Al (OH)3 og HtoCO3; som er lig med en brusende opløsning med et hvidt bundfald.
Denne blanding har medicinske anvendelser. Imidlertid til det rene, isolerbare og manipulerbare salt af Alto(CO3)3, ingen kendte mulige anvendelser i det mindste ikke under enormt pres eller ekstreme forhold.
Artikelindeks
- 1 Struktur af aluminiumcarbonat
- 1.1 Aluminiumammoniumhydroxidcarbonat
- 2 egenskaber
- 2.1 Molær masse
- 2.2 ustabilitet
- 2.3 Fysisk
- 3 anvendelser
- 4 Referencer
Struktur af aluminiumcarbonat
Krystalstrukturen til dette salt er ukendt, fordi den er så ustabil, at den ikke kunne karakteriseres. Fra dets formel Alto(CO3)3, Det er imidlertid kendt, at andelen af Al-ioner3+ og CO3to- er 2: 3; det vil sige for hver anden Al-kationto+ der skal være tre CO-anioner3to- interagerer elektrostatisk med dem.
Problemet er, at begge ioner er meget forskellige i størrelse; Al3+ er meget lille, mens CO3to- det er klodset. Denne forskel i sig selv påvirker allerede gitterstabiliteten af krystalgitteret, hvis ioner ville interagere "akavet", hvis dette salt kunne isoleres i fast tilstand.
Ud over dette aspekt har Al3+ det er en meget polariserende kation, en egenskab der deformerer den elektroniske CO-sky3to-. Det er som om du vil tvinge det til at binde kovalent, selvom anionen ikke kan..
Derfor er ioniske interaktioner mellem Al3+ og CO3to- de har tendens til kovalens; en anden faktor, der øger ustabiliteten af Alto(CO3)3.
Aluminiumammoniumhydroxidcarbonat
Det kaotiske forhold mellem Al3+ og CO3to- blødgør i udseende, når andre ioner er til stede i glasset; såsom NH4+ og OH-, fra en opløsning af ammoniak. Denne kvartet af ioner, Al3+, CO3to-, NH4+ og OH-, de formår at definere stabile krystaller, endog i stand til at anvende forskellige morfologier.
Et andet eksempel svarende til dette observeres i mineralet dawsonite og dets orthorhombiske krystaller, NaAlCO3(OH)to, hvor Na+ erstatter NH4+. I disse salte er deres ionbindinger stærke nok til, at vandet ikke fremmer frigivelsen af CO.to; eller i det mindste ikke brat.
Selvom NH4Al (OH)toCO3 (AACC, for dets akronym på engelsk) eller NaAlCO3(OH)to repræsenterer aluminiumcarbonat, kan de betragtes som basiske derivater deraf.
Ejendomme
Molar masse
233,98 g / mol.
Ustabilitet
I det forrige afsnit blev det forklaret ud fra et molekylært perspektiv, hvorfor Alto(CO3)3 det er ustabilt. Men hvilken transformation gennemgår den? Der er to situationer at overveje: den ene tør og den anden "våd".
Tør
I den tørre situation anionen CO3to- vender tilbage til COto ved følgende nedbrydning:
Tilto(CO3)3 => AltoELLER3 + 3COto
Hvilket giver mening, hvis det syntetiseres under højt CO-tryk.to; det vil sige den omvendte reaktion:
TiltoELLER3 + 3COto => Alto(CO3)3
Derfor for at forhindre Alto(CO3)3 saltet skal udsættes for højt tryk (ved brug af Nto, for eksempel). På denne måde dannes COto ville ikke blive foretrukket termodynamisk.
Våd
Mens i den våde situation, CO3to- gennemgår hydrolyse, som genererer små mængder OH-; men nok til at udfælde aluminiumhydroxidet, Al (OH)3:
CO3to- + HtoELLER <=> HCO3- + Åh-
Til3+ + 3OH- <=> Al (OH)3
Og på den anden side Al3+ hydrolyserer også:
Til3+ + HtoELLER <=> Al (OH)toto+ + H+
Selvom Al faktisk ville hydrere først3+ til dannelse af komplekset Al (HtoELLER)63+, som hydrolyseres for at give [Al (HtoELLER)5OH]to+ og H3ELLER+. Så H3O (eller H+) proton til CO3to- til HtoCO3, som nedbrydes til COto og HtoELLER:
CO3to- + 2H+ => HtoCO3
HtoCO3 <=> COto + HtoELLER
Bemærk, at i sidste ende Al3+ opfører sig som en syre (frigiver H+) og en base (frigiver OH- med opløselighedsbalancen af Al (OH)3); det vil sige, det udviser amfoterisme.
Fysisk
Hvis det kan isoleres, vil dette salt sandsynligvis have hvid farve, ligesom mange andre aluminiumsalte. På grund af forskellen mellem de ioniske radier af Al3+ og CO3to-, det ville helt sikkert have meget lave smelte- eller kogepunkter sammenlignet med andre ioniske forbindelser.
Og med hensyn til dets opløselighed ville den være uendelig opløselig i vand. Desuden ville det være et hygroskopisk og deliquescent fast stof. Dette er dog bare gætterier. Andre egenskaber skulle estimeres med computermodeller udsat for høje tryk..
Ansøgninger
De kendte anvendelser af aluminiumcarbonat er medicinske. Det blev brugt som en mild astringerende og som et middel til behandling af mavesår og betændelse. Det er også blevet brugt til at forhindre dannelse af urinsten hos mennesker..
Det er blevet brugt til at kontrollere en stigning i kroppens fosfatindhold og også til behandling af symptomer på halsbrand, syre fordøjelsesbesvær og mavesår..
Referencer
- XueHui L., Zhe T., YongMing C., RuiYu Z. & Chenguang L. (2012). Hydrotermisk syntese af ammoniumaluminiumcarbonathydroxid (AACH) Nanoplader og nanofibre pH-kontrollerede morfologier. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Ammoniumaluminiumcarbonathydroxid NH4Al (OH) 2CO3 som en alternativ rute til aluminiumoxidfremstilling: sammenligning med den klassiske boehmitforløber. Pulverteknologi, 320, 565-573, DOI: 10.1016 / j.powtec.2017.07.0080
- National Center for Biotechnology Information. (2019). Aluminiumcarbonat. PubChem Database., CID = 10353966. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Aluminiumcarbonat. Gendannet fra: en.wikipedia.org
- Aluminiumsulfat. (2019). Aluminiumkarbonat. Gendannet fra: aluminiumsulfate.net



Endnu ingen kommentarer