
Lithiumcarbonat (Li2CO3) struktur, egenskaber, anvendelser

Det lithiumcarbonat er et uorganisk fast stof dannet af to lithium Li-kationer+ og en carbonatanion CO3to-. Dens kemiske formel er LitoCO3. LitoCO3 er et hvidt krystallinsk fast stof, der kan opnås ved reaktionen mellem lithiumhydroxid og kuldioxid.
Lithiumcarbonat har et meget højt smeltepunkt, hvorfor det bruges til fremstilling af glas, keramik og porcelæn. Det har en lang række anvendelser, såsom i genopladelige lithiumbatterier, til fremstilling af andre lithiumforbindelser, i svejseelektroder og i maling og lak..

Li bruges ogsåtoCO3 i cementblandinger til hurtig hærdning og aluminiumsproduktion.
En af dens vigtigste anvendelser er i behandlingen af nogle psykiske sygdomme såsom depression og overdreven aggressiv adfærd, blandt andre forhold..
Imidlertid skal dets anvendelse som medicin kontrolleres behørigt af lægespecialister, da personer behandlet med LitoCO3 kan have skadelige virkninger på dit helbred, såsom hypothyroidisme (nedsat funktion af skjoldbruskkirtlen).
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 Fysiske egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Nedbrydning
- 3.5 Densitet
- 3.6 Opløselighed
- 3,7 pH
- 4 Kemiske egenskaber
- 5 Biologiske egenskaber
- 6 Opnåelse
- 7 anvendelser
- 7.1 I behandlingen af psykiske sygdomme
- 7.2 Ved behandling af symptomer på andre sygdomme
- 7.3 Administration
- 8 Bivirkninger
- 8.1 Tilfælde, hvor det ikke skal administreres
- 9 Andre anvendelser
- 10 Referencer
Struktur
Lithiumcarbonat består af to lithium Li-kationer+ og en carbonatanion CO3to-.
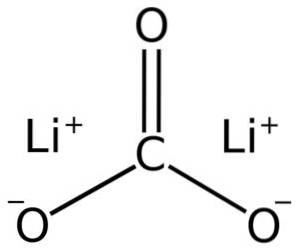
Elektronkonfigurationen af lithium i oxidationstilstand +1 er 1sto 2s0, da den har mistet elektronen fra den sidste skal og dermed er mere stabil. Carbonationen CO3to- har en flad struktur.
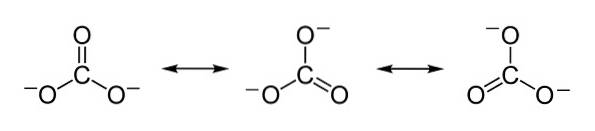
Negative ladninger fordeles ligeligt mellem de tre iltatomer i carbonationen CO3to-.
Nomenklatur
-Lithiumcarbonat
-Dilithiumcarbonat
Fysiske egenskaber
Fysisk tilstand
Hvidt krystallinsk fast stof med monoklinisk struktur
Molekylær vægt
73,9 g / mol
Smeltepunkt
723 ºC
Nedbrydning
Den nedbrydes ved 1300 ºC.
Massefylde
2,11 g / cm3
Opløselighed
Let opløselig i vand: 1,31 vægtprocent ved 20 ºC. Dens opløselighed i vand falder med stigende temperatur. Det er opløseligt i fortyndede syrer. Det er uopløseligt i alkohol og acetone.
pH
Opløsninger i vand er basiske, har en pH større end 7.
Kemiske egenskaber
LitoCO3 hydrolyseres i vandig opløsning og genererer en basisk opløsning. Den lille del af forbindelsen, der er solubiliseret i vand, efterlader carbonatanionen CO fri.3to-.
Carbonatanionen CO3to- fri i vandig opløsning tager en proton til dannelse af bicarbonatanionen HCO3-, som det kan ses i følgende reaktion:
CO3to- + HtoO → HCO3- + Åh-
Tilstedeværelsen af OH-ioner- er det, der gør løsningen grundlæggende.
Biologiske egenskaber
Spor af lithiumion er normalt til stede i dyre- og humane væv, men ingen naturlig fysiologisk rolle af denne ion er hidtil kendt..
I den menneskelige organisme er LitoCO3 indtages som et lægemiddel, virker det på en række signalmekanismer i neuroner og andre celler. Dette skyldes substitution af kationer, såsom natrium og kalium.
Inkorporeringen af lithiumion i cellemembranens struktur kan ændre reaktionen på hormoner og koblingen af cellen med energiprocesser.
På denne måde modificerer lithium flere cellulære processer inklusive metabolisme..
Gennem at ændre den måde celler fungerer på, LitoCO3 kan handle på kommunikationsmekanismerne for neuroner i hjernen.
Opnåelse
LitoCO3 kan opnås ved omsætning af lithiumhydroxid LiOH med carbondioxid COto, som vist nedenfor:
2 LiOH + COto → LitoCO3 + HtoELLER
Det er kommercielt produceret af lithiumholdige mineraler såsom spodumen og lepidolit. Disse mineraler behandles ved høje temperaturer med visse sulfatsalte eller med alkaliske forbindelser for at opnå lithiumsalte..
De opnåede lithiumsalte oprenses med vand eller syreopløsninger og behandles derefter med carbonater til dannelse af LitoCO3.
Imidlertid er LitoCO3 Opnået på denne måde er det forurenet med sulfater eller klorider af calcium, magnesium, jern, natrium, kalium osv. så det kræver yderligere oprensning.
Ansøgninger
I behandlingen af psykisk sygdom
Det bruges som et antidepressivt, antimanisk middel til behandling af aggressiv-impulsiv adfærd og til bipolare lidelser (mennesker, der pludselig ændrer humør uden grund, bliver voldelige).

Læger har observeret, at dets administration fører til et fald i intensiteten og hyppigheden af svære perioder med depression og maniske episoder..
Det bruges alene, dvs. uden tilsat forbindelse, til vedligeholdelsesbehandling af unipolar depression og til skizoaffektiv lidelse. Det tjener også til at øge den antidepressive virkning af andre lægemidler.
Selvom det er blevet brugt til at behandle børn med tilsyneladende symptomer på bipolar lidelse og hyperaktivitet med neurotiske eller aggressive komponenter, har det ikke været effektivt i alle tilfælde..
Ved behandling af symptomer på andre sygdomme
Det bruges til at reducere hyppigheden af svær, tilbagevendende og kronisk hovedpine.
Det bruges til at reducere forekomsten af infektion hos patienter med neutropeni induceret af kemoterapi eller af andre grunde. Neutropeni er et fald i neutrofiler, en type hvide blodlegemer, der hjælper med at bekæmpe infektioner i kroppen.
Det er blevet brugt som en skjoldbruskkirtelenzyminhibitor til behandling af hyperthyroidisme, men det er ikke den foretrukne behandling på grund af dets bivirkninger.
Administrationsform
Det bruges i form af tabletter eller kapsler af LitoCO3. Også i tabletter med langsom frigivelse med lithiumcitrat. Li foretrækkestoCO3 fordi det ikke irriterer halsen ved indtagelse, som det er tilfældet med andre lithiumsalte.

Bivirkninger
LitoCO3 kan have en skadelig virkning på skjoldbruskkirtlen og nyrerne, så disse organers funktion skal overvåges før og under behandling med denne forbindelse..
LitoCO3 det kan være giftigt i koncentrationer meget tæt på dem, der anvendes i medicinske behandlinger, så der kræves en kontinuerlig gennemgang af dets værdier i blodserum.
Symptomer på Li-forgiftningtoCO3 er tremor, muskelspasmer, muskelsvaghed, diarré, opkastning, døsighed eller ataksi (nedsat muskelkoordination), blandt andre.
Når du starter behandling med LitoCO3 Symptomer såsom rysten, hovedpine og kvalme kan også forekomme. Men disse forsvinder, når medicinen fortsætter..
De fleste behandlede kan også udvikle leukocytose (en stigning i antallet af hvide blodlegemer), men dette er reversibelt..
Folk, der får medicin med LitoCO3 de bør ikke køre bil eller betjene maskiner, fordi fysisk koordinering og evnen til at udføre aktiviteter, der kræver årvågenhed, falder.
Tilfælde, hvor det ikke skal administreres
Det bør ikke bruges til børn under 12 år, da det kan forstyrre dannelsen af knogler og dens densitet, da det ændrer koncentrationerne af et skjoldbruskkirtelhormon. Det har også en tendens til at tage stedet for calcium i knoglerne..
De bør ikke behandles med LitoCO3 mennesker med hjerte-kar-, nyre- eller skjoldbruskkirtelsygdom. Hverken hos stærkt dehydreret patienter.
Det bør ikke gives til gravide kvinder, især i graviditetens første trimester. Lithium krydser moderkagen og kan let nå fosteret med mulige teratogene virkninger, det vil sige det kan forårsage abnormiteter eller misdannelser hos det ufødte barn..
Ældre mennesker, der har behov for behandling med LitoCO3 bør behandles med stor omhu og med lavere doser end unge voksne, da de kan udvikle hypothyroid sygdom.
Andre anvendelser
LitoCO3 høj renhed anvendes i vid udstrækning til fremstilling af genopladelige lithiumbatterier.
Anvendes i smeltede carbonatbrændselsceller.
Det bruges til fremstilling af elektrisk porcelæn, som er en type elektrisk isolerende porcelæn. Det bruges også til produktion af glasur på keramik.

Det gør det muligt at fremstille keramik med en lav ekspansionskoefficient, det vil sige, den udvides meget lidt med stigende temperatur, så keramikken kan bruges i et højere temperaturområde.
Andre anvendelser er som en katalysator til fremstilling af andre lithiumforbindelser, som en belægning til svejseelektroder, i selvlysende malingsformler, lakker og farvestoffer såvel som ved elektrolytisk produktion af aluminium..
Det er nyttigt at generere en hurtigere indstilling af cementen og føjes til limen på fliserne, så de kan fastgøres på kort tid.

Referencer
- Cai, W. et al. (2018). Fjernelse af SO4to- fra LitoCO3 ved omkrystallisation i NatoCO3. Krystaller 2018, 8, 19. Gendannet fra mdpi.com.
- Gadikota, G. (2017). Forbindelse af de morfologiske og krystalstrukturelle ændringer under omdannelsen af lithiumhydroxidmonohydrat til lithiumcarbonat ved hjælp af målinger til spredning af røntgenstråle i flere skala. Mineraler 2017, 7, 169. Gendannet fra mdpi.com.
- OS. National Library of Medicine. (2019). Lithiumcarbonat. Gendannet fra: pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fjerde udgave. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte udgave. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avanceret uorganisk kemi. Fjerde udgave. John Wiley & Sons.


Endnu ingen kommentarer