
Krystallinsk faststofstruktur, egenskaber, typer, eksempler

Det krystallinske faste stoffer Det er dem, hvis mikroskopiske strukturer er ordnet og adlyder et karakteristisk mønster for et givet krystalgitter; for eksempel: cubic, hexagonal, triclinic, rhombohedral, blandt andre.
Disse faste stoffer siges at eksistere som krystaller, der viser facetter og geometriske mønstre, der afspejler hvor ordnede de er indeni. Andre eksempler på krystallinske faste stoffer er diamant, kvarts, anthracen, tøris, kaliumchlorid eller magnesiumoxid..

Et velkendt par krystallinske faste stoffer er sukker og salt (NaCl). Ved første øjekast viser begge hvide krystaller; men deres egenskaber adskiller sig enormt. Sukker er et molekylært krystallinsk fast stof, mens salt er et ionisk krystallinsk fast stof. Den første består af saccharosemolekyler; og det andet af Na-ioner+ og Cl-.
Billedet ovenfor giver et glimt af, hvor lyse sukkerkrystaller kan være. Saltkrystallerne er dog ikke langt bagud. Selvom sukker og salt ser ud som brødre, er deres strukturer forskellige: sukker, som er saccharose, har en monoklinisk struktur; mens salt, en kubisk struktur.
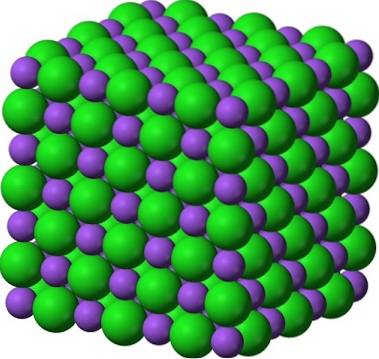
Pulveriseret sukker og salt (glasur) forbliver krystallinsk; dets krystaller er kun blevet så meget mindre for vores øjne. Krystalliniteten af et fast stof defineres derfor mere af dets indre struktur end af dets ydre udseende eller dets lysstyrke..
Artikelindeks
- 1 Struktur af krystallinske faste stoffer
- 2 egenskaber
- 3 typer krystallinske faste stoffer
- 3.1 Ionisk
- 3.2 Metallisk
- 3.3 Molekylær
- 3.4 Kovalente netværk
- 4 eksempler
- 4.1 Ionisk
- 4.2 Metallisk
- 4.3 Molekylær
- 4.4 Kovalente netværk
- 5 Referencer
Struktur af krystallinske faste stoffer
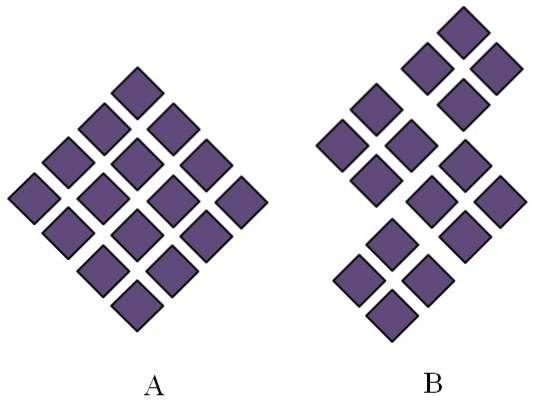
Krystallinske faste stoffer har ordnede strukturer. Deres geometriske egenskaber vil afhænge af typen af krystallinsk gitter, som de tilhører, hvilket igen projiceres eksternt i form af krystallen (krystallinsk system). Billedet ovenfor illustrerer to vigtige begreber i sådanne strukturer: periodicitet og krystallinske korn..
Den rumlige rækkefølge af partiklerne i et krystallinsk fast stof er periodisk; det vil sige, det gentager sig igen og igen i alle retninger. Dette skaber sit eget strukturelle mønster for hvert fast og krystalgitter; for eksempel er det her salt og sukker begynder at skelne ud over deres kemiske natur.
I A er romberne arrangeret til at give anledning til en rombe af større proportioner. Hver lilla rombe repræsenterer en partikel eller et sæt partikler (atomer, ioner eller molekyler). Således kan en makroskopisk krystal af A forventes at have et rombohedral udseende..
I mellemtiden er romberne i B arrangeret på en sådan måde, at de giver anledning til krystallinske korn; disse er meget små krystaller (krystallitter). B siges derefter at være et polykrystallinsk fast stof; det vil sige, det dannes ved agglomerering af flere krystallitter.
Som konklusion kan et fast stof simpelthen være krystallinsk (A) eller polykrystallinsk (B); A danner krystaller, mens B polykrystaller.
Ejendomme
Egenskaberne af krystallinske faste stoffer afhænger af deres krystalltype. Det er allerede kendt, at deres strukturer er ordnede, og at de også har en tendens til at præsentere lyse træk, som mineralelskere forelsker sig i. Imidlertid blev det nævnt, at et pulverformigt fast stof, selv "off", også kan klassificeres som krystallinsk..
Den måde, hvorpå deres partikler er rumligt orienteret, giver dem mulighed for at have nogle vigtige egenskaber til deres karakterisering. For eksempel er krystallinske faste stoffer i stand til diffraktion af røntgenstråler, hvilket skaber diffraktionsspektre, hvorfra den mikroskopiske struktur af en krystal kan bestemmes..
Da strukturen er periodisk, diffunderer varmen også på samme måde gennem det faste stof; så længe der ikke er urenheder involveret. Således er smeltepunkterne for et krystallinsk fast stof konstant og varierer ikke, uanset hvordan de måles..
Typer af krystallinske faste stoffer
Typerne af krystallinske faste stoffer er baseret på, hvilken type partikler de er lavet af, og hvad deres interaktioner eller bindinger er. Der er i det væsentlige fire typer: ioniske, metalliske, molekylære og kovalente netværk.
Selv når de udviser en vis grad af urenheder, er de fortsat krystallinske, selvom deres egenskaber påvirkes, og de ikke viser de samme værdier, der forventes for et rent fast stof..
Ionik
Salt er et eksempel på et ionisk krystallinsk fast stof, da det består af Na-ioner+ og Cl-. Derfor regulerer den ioniske binding i denne type faste stoffer: det er de elektrostatiske kræfter, der styrer den strukturelle rækkefølge..
Metallisk
Alle metalliske atomer danner metalliske krystaller. Dette betyder, at for eksempel en sølvgaffel er et konglomerat af smeltede sølvkrystaller. Den interne eller mikroskopiske struktur er den samme i hvert håndspænd af objektet og forbliver uændret fra gaffelhåndtaget til spidsen af tænderne..
Molekylær
Sukker er et eksempel på et molekylært krystallinsk fast stof, da det består af saccharosemolekyler. Derfor består denne type fast stof af molekyler, som gennem deres intermolekylære interaktioner (og ikke kovalente bindinger) formår at etablere en ordnet struktur..
Kovalente netværk
Endelig har vi de krystallinske faste stoffer i kovalente netværk. Kovalente bindinger dominerer i dem, da de er ansvarlige for at etablere en ordre og holde atomerne stærkt faste i deres respektive rumlige positioner. Vi taler ikke om ioner, atomer eller molekyler, men om tredimensionelle netværk.
Eksempler
Dernæst og endelig vil nogle eksempler blive nævnt for hver af typerne af krystallinske faste stoffer.
Ionik
Alle salte er ioniske faste stoffer. Ligeledes er der sulfider, hydroxider, oxider, halogenider og andre forbindelser, der også består af ioner, eller deres interaktioner er i det væsentlige ioniske. Så vi har:
-KCl
-Sag4
-Ba (OH)to
-RUTE4
-FeCl3
-NatoS
-MgO
-CaFto
-NaHCO3
-(NH4)toCrO4
Ud over disse eksempler betragtes langt størstedelen af mineraler som ioniske krystallinske faste stoffer.
Metallisk
Ethvert metalelement forekommer naturligt som metalliske krystaller. Nogle af dem er:
-Kobber
-Jern
-Aluminium
-Chrome
-Metallisk brint (under ufattelige tryk)
-Wolfram
-Zirkonium
-Titanium
-Magnesium
-Natrium
Molekylær
Der er et stort udvalg af molekylære krystallinske faste stoffer. Næsten enhver organisk forbindelse, der størkner, kan etablere krystaller, hvis dens renhed er høj, eller hvis dens struktur ikke er for indviklet. Så vi har:
-Is (HtoELLER)
-Tøris (COto)
-jegto
-P4
-S8 (og dens polymorfe)
-Antracen
-Fast ilt
-Fast ammoniak
-Phenolphthalein
-Benzoesyre
Kovalente netværk
Og endelig har vi blandt nogle krystallinske faste stoffer i kovalente netværk:
-Diamant
-Grafit
-Carbon nanorør
-Fullerener
-Kvarts
-Silicium
-Germanium
-Bor nitrid
Fra denne liste kan kulstofnanorør og fullerener også betragtes som molekylære krystallinske faste stoffer. Dette skyldes, at selvom de består af kovalent bundne carbonatomer, definerer de enheder, der kan visualiseres som makromolekyler (fodboldkugler og rør)..
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Wikipedia. (2020). Krystal. Gendannet fra: en.wikipedia.org
- Kemi LibreTexts. (16. juni 2019). Krystallinske og amorfe faste stoffer. Gendannet fra: chem.libretexts.org
- Rachel Bernstein og Anthony Carpi. (2020). Egenskaber for faste stoffer. Gendannet fra: visionlearning.com



Endnu ingen kommentarer