
Calciumcarbid (CaC2) struktur, egenskaber, produktion, anvendelser

Det calciumcarbid Det er en uorganisk forbindelse dannet af grundstofferne calcium (Ca) og carbon (C). Dens kemiske formel er CaCto. Det er et fast stof, der kan være farveløst til gulligt eller gråhvidt og endda sort afhængigt af urenhederne i det.
En af dens vigtigste kemiske reaktioner af CaCto er, hvad der sker med vand HtoEller hvor acetylen HC2CH dannes. Af denne grund bruges det til at opnå acetylen på en industriel måde. På grund af den samme reaktion med vand, bruges det til at modne frugter, i falske kanoner og i flådestøv..

CaC-reaktionento med vand producerer også et nyttigt slam til forberedelse af klinker (en komponent af cement), der producerer mindre kuldioxid (COto) sammenlignet med den traditionelle metode til fremstilling af cement.
Med nitrogen (Nto) calciumcarbid danner calciumcyanamid, som bruges som gødning. CaCto det bruges også til at fjerne svovl fra visse metallegeringer.
For nogen tid siden blev CaCto Det blev brugt i såkaldte hårdmetallamper, men disse er ikke længere almindelige, fordi de er farlige.
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Kogepunkt
- 3.5 Densitet
- 3.6 Kemiske egenskaber
- 4 Opnåelse
- 5 anvendelser
- 5.1 I produktionen af acetylen
- 5.2 I reduktion af CO2-emissioner
- 5.3 Ved opnåelse af calciumcyanamid
- 5.4 I den metallurgiske industri
- 5.5 I forskellige anvendelser
- 5.6 Ophørt brug
- 6 risici
- 7 Referencer
Struktur
Calciumcarbid er en ionforbindelse og består af calciumionen Cato+ og carbidet eller acetylidionen Ctoto-. Carbidionen består af to carbonatomer forbundet med en tredobbelt binding.
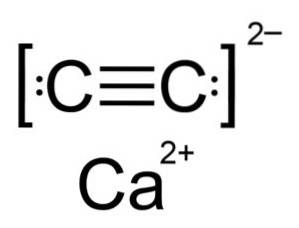
Krystalstrukturen af CaCto stammer fra kubikken (som natriumchlorid NaCl), men som C-ionentoto- er langstrakt strukturen er forvrænget og bliver tetragonal.
Nomenklatur
- Calciumcarbid
- Calciumcarbid
- Calciumacetylid
Ejendomme
Fysisk tilstand
Krystallinsk fast stof, som når det er rent er farveløst, men hvis det er forurenet med andre forbindelser, kan det være gulhvidt eller gråligt til sort.

Molekylær vægt
64,0992 g / mol
Smeltepunkt
2160 ºC
Kogepunkt
CaCto det koger ved 2300 ºC med nedbrydning. Kogepunktet måles under en inert atmosfære, dvs. uden ilt eller fugt..
Massefylde
2,22 g / cm3
Kemiske egenskaber
Calciumcarbid reagerer med vand til dannelse af acetylen HC2CH og calciumhydroxid Ca (OH)to:
CaCto + 2 timertoO → HC2CH + Ca (OH)to
Acetylen er brandfarligt, derfor CaC i nærvær af fugtto det kan være brandfarligt. Men når det er tørt, er det ikke.

Calciumcarbid reagerer med nitrogen Nto til dannelse af calciumcyanamid CaCNto:
CaCto + Nto → CaCNto + C
Opnåelse
Calciumcarbid produceres industrielt i en elektrisk lysbueovn startende fra en blanding af calciumcarbonat (CaCO3) og kulstof (C), der udsættes for en temperatur på 2000 ° C. Reaktionen er opsummeret således:
Tyv3 + 3 C → CaCto + CO ↑ + COto↑
Eller også:
CaO + 3 C → CaCto + CO ↑
I en elektrisk lysbueovn produceres en lysbue mellem to grafitelektroder, der modstår de høje temperaturer, der dannes. Der opnås et calciumcarbid med 80-85% renhed.
Ansøgninger
I produktionen af acetylen
Industrielt anvendes reaktionen af calciumcarbid med vand til fremstilling af acetylen CtoHto.
CaCto + 2 timertoO → HC2CH + Ca (OH)to
Dette er den vigtigste anvendelse af calciumcarbid. I nogle lande er acetylen højt værdsat, da det gør det muligt at producere polyvinylchlorid, som er en type plast. Derudover anvendes acetylen til svejsning ved høje temperaturer.

I reduktion af CO-emissionerto
Resterne opnået ved opnåelse af acetylen startende fra CaCto (også kaldet "calciumcarbidslam" eller "calciumcarbidrester") bruges til at opnå klinker eller beton.
Calciumcarbidslam har et højt indhold af calciumhydroxid (Ca (OH))to90%), noget calciumcarbonat (CaCO3) og har en pH større end 12.

Af disse grunde kan det reagere med SiOto mundtligtoELLER3 dannelse af et produkt svarende til det opnået ved cementhydratiseringsprocessen.
En af de menneskelige aktiviteter, der producerer mest CO-emissionerto det er byggebranchen. COto genereres mod øst, frigøres fra calciumcarbonat under reaktionen til dannelse af beton.
Brug af calciumcarbidslam til erstatning af calciumcarbonat (CaCO3) har vist sig at mindske CO -emissionerneto med 39%.
Ved opnåelse af calciumcyanamid
Calciumcarbid anvendes også industrielt til opnåelse af calciumcyanamid CaCNto.
CaCto + Nto → CaCNto + C
Calciumcyanamid bruges som gødning, fordi det med jordvand omdannes til cyanamid H2N = C = N, hvilket giver kvælstof til planter, et vigtigt næringsstof for dem.
I den metallurgiske industri
Calciumcarbid bruges til at fjerne svovl fra legeringer såsom ferronickel. CaC blandesto med legeringen smeltet ved 1550 ° C. Svovl (S) reagerer med calciumcarbid og producerer calciumsulfid CaS og carbon C:
CaCto + S → 2 C + CaS
Svovlfjernelse foretrækkes, hvis blanding er effektiv, og kulstofindholdet i legeringen er lavt. Calciumsulfidet CaS flyder på overfladen af den smeltede legering, hvorfra den dekanteres og kasseres..
I forskellige anvendelser
Calciumcarbid er blevet brugt til at fjerne svovl fra jern. Også som brændstof i stålproduktion og som en kraftig deoxideringsmiddel.
Det bruges til at modne frugt. Acetylen genereres af calciumcarbid med vand, hvilket inducerer modning af frugter, såsom bananer..

Calciumcarbid bruges i dummy-kanoner til at forårsage den kraftige bang-støj, der karakteriserer dem. Her bruges også dannelsen af acetylen, som eksploderer med en gnist inde i enheden.
CaCto brugt til at generere signaler offshore i selvantændende flådeblink.
Udgået brug
CaCto det er blevet brugt i såkaldte hårdmetallamper. Driften af disse består af dryppende vand på calciumcarbidet til dannelse af acetylen, som antændes og på denne måde giver lys.
Disse lamper blev brugt i kulminer, men deres anvendelse blev afbrudt på grund af tilstedeværelsen af metangassen CH4 i disse miner. Denne gas er brandfarlig, og flammen fra hårdmetallampen kan få den til at antænde eller eksplodere..

De blev meget brugt i skifer-, kobber- og tinstenminer og også i tidlige biler, motorcykler og cykler som forlygter eller forlygter.
I øjeblikket er de blevet erstattet af elektriske lamper eller endda LED-lamper. De bruges dog stadig i lande som Bolivia, i sølvminerne i Potosí.
Risici
Calciumcarbid CaCto tørt er det ikke brandfarligt, men i nærværelse af fugtighed danner det hurtigt acetylen, som det er.
For at slukke en brand i nærværelse af CaCto vand, skum, kuldioxid eller halogenslukkere bør aldrig anvendes. Sand eller natrium eller calciumhydroxid skal anvendes.
Referencer
- Ropp, R.C. (2013). Gruppe 14 (C, Si, Ge, Sn og Pb) alkaliske jordforbindelser. Calciumcarbider. I Encyclopedia of the Alkaline Earth Compounds. Gendannet fra sciencedirect.com.
- Pohanish, R. P. (2017). C. Calciumcarbid. I Sittigs håndbog om giftige og farlige kemikalier og kræftfremkaldende stoffer (syvende udgave). Gendannet fra sciencedirect.com.
- Sun, H. et al. (2015). Egenskaber ved kemisk forbrændt calciumcarbidrest og dens indflydelse på cementegenskaber. Materialer 2015, 8, 638-651. Gendannet fra ncbi.nlm.nih.gov.
- Nie, Z. (2016). Miljømateriale og livscyklusvurdering. Casestudie: COto Emissionsanalyse af calciumcarbidslamklinker. I grøn og bæredygtig fremstilling af avanceret materiale. Gendannet fra sciencedirect.com.
- Crundwell, F.K. Et al. (2011). Raffinering af smeltet ferronickel. Fjernelse af svovl. I ekstraktionsmetallurgi af nikkel-, kobolt- og platinagruppemetaller. Gendannet fra sciencedirect.com.
- Tressler, R.E. (2001). Strukturel og termostrukturel keramik. Karbider. I Encyclopedia of Materials Science and Technology. Gendannet fra sciencedirect.com.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avanceret uorganisk kemi. Fjerde udgave. John Wiley & Sons.



Endnu ingen kommentarer