
Formel opladningsformel, hvordan man beregner det og eksempler
Det formel afgift (CF) er et, der er tildelt et atom i et molekyle eller en ion, der gør det muligt at forklare dets strukturer og kemiske egenskaber baseret på det. Dette koncept indebærer overvejelse af den maksimale karakter af kovalens i bindingen A-B; det vil sige, at elektronparret deles ligeligt mellem A og B.
For at forstå ovenstående viser det nederste billede to sammenkædede atomer: det ene er betegnet med bogstavet A og det andet med bogstavet B. Som det kan ses, dannes der i skæringen af cirklerne en binding med parret ":". I dette heteronukleære molekyle, hvis A og B har lige elektronegativiteter, forbliver parret ":" lige langt fra både A og B.
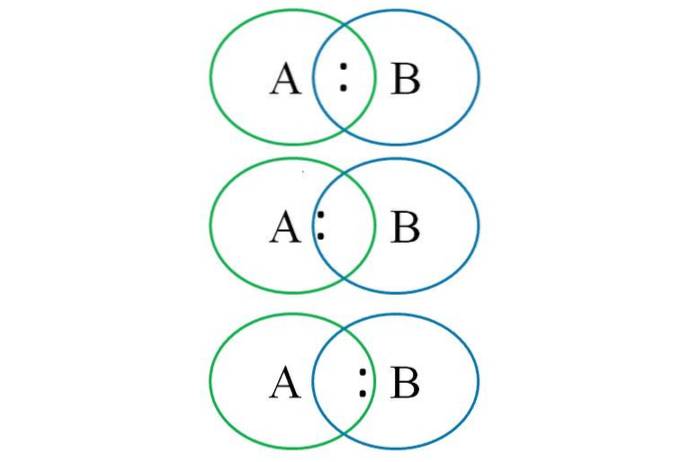
Da to forskellige atomer ikke kan have identiske egenskaber, tiltrækkes parret ":" imidlertid af det, der er mere elektronegativt. I dette tilfælde, hvis A er mere elektronegativ end B, er parret ":" tættere på A end til B. Det modsatte sker, når B er mere elektronegativ end A, nærmer sig nu ":" til B.
Så for at tildele de formelle afgifter til både A og B er det nødvendigt at overveje den første sag (den over billedet). Hvis den rent kovalente binding A-B blev brudt, ville der opstå et homolytisk brud, der dannede de frie radikaler A · og · B.
Artikelindeks
- 1 Kvalitative fordele ved ansættelse af den formelle belastning
- 2 Formel og hvordan man beregner den
- 2.1 Variationer i beregningen i henhold til strukturen
- 3 Eksempler på beregninger af formelle belastninger
- 3.1 BF4- (tetrafluorboration)
- 3.2 BeH2 (berylliumhydrid)
- 3.3 CO (kulilte)
- 3,4 NH4 + (ammoniumion), NH3 og NH2- (amidion)
- 4 Referencer
Kvalitative fordele ved ansættelse af den formelle belastning
Elektronerne er ikke faste, som i det foregående eksempel, men bevæger sig og går tabt gennem molekylets eller ionens atomer. Hvis det er et diatomisk molekyle, er det kendt, at parret ":" skal deles eller vandrer mellem begge atomer; det samme sker i et molekyle af typen A-B-C, men med større kompleksitet.
Men når man studerer et atom og antager en kovalens på hundrede procent i dets bindinger, er det lettere at fastslå, om det vinder eller mister elektroner i forbindelsen. For at bestemme denne gevinst eller tab skal din baseline eller fri tilstand sammenlignes med dit elektroniske miljø..
På denne måde er det muligt at tildele en positiv ladning (+), hvis atomet mister en elektron eller en negativ ladning (-) når det tværtimod vinder en elektron (tegnene skal skrives inde i en cirkel).
Selvom elektronerne ikke kan placeres nøjagtigt, svarer disse formelle ladninger (+) og (-) på strukturer i de fleste tilfælde til de forventede kemiske egenskaber..
Det vil sige, at den formelle ladning af et atom er tæt forbundet med dets molekylære geometri og dets reaktivitet i forbindelsen..
Formel og hvordan man beregner den
Tildeles formelle afgifter vilkårligt? Svaret er nej. Til dette skal gevinst eller tab af elektroner beregnes under forudsætning af rent kovalente bindinger, og dette opnås ved hjælp af følgende formel:
CF = (atomnummerets gruppe) - (antallet af bindinger det danner) - (antallet af ikke-delte elektroner)
Hvis atomet har en CF med en værdi på +1, tildeles det en positiv ladning (+); hvorimod hvis du har en CF med værdien -1, tildeles den en negativ ladning (-).
For korrekt beregning af CF skal følgende trin følges:
- Find i hvilken gruppe atomet findes i det periodiske system.
- Tæl antallet af obligationer, det danner med sine naboer: dobbeltbindinger (=) er to værd, og tredobbelte obligationer er tre værd (≡).
- Endelig tælle antallet af ikke-delte elektroner, som let kan observeres med Lewis-strukturer.
Beregningsvariationer efter struktur
I betragtning af det lineære molekyle A-B-C-D kan de formelle ladninger for hvert atom variere, hvis strukturen for eksempel nu er skrevet som: B-C-A-D, C-A-B-D, A-C-D-B osv. Dette skyldes, at der er atomer, der ved at dele flere elektroner (danner flere bindinger) får positiv eller negativ CF.
Så hvilken af de tre mulige molekylære strukturer svarer til forbindelse ABCD? Svaret er: den, der generelt har de laveste CF-værdier; ligeledes den, der tildeler negative ladninger (-) til de mest elektronegative atomer.
Hvis C og D er mere elektronegative end A og B, får de følgelig formelle positive ladninger ved at dele flere elektroner (set fra en mnemonisk regel).
Således er den mest stabile struktur og den mest energisk foretrukne C-A-B-D, da både C og B kun danner en binding i dette. På den anden side er strukturen A-B-C-D og dem, der har C eller B, der danner to bindinger (-C- eller -D-), mere ustabile.
Hvilken af alle strukturer er den mest ustabile? A-C-D-B, fordi ikke kun C og D danner to obligationer, men også deres formelle negative ladninger (-) støder op til hinanden, hvilket yderligere destabiliserer strukturen.
Eksempler på formelle belastningsberegninger
BF4- (tetrafluorboration)
Boratomet er omgivet af fire fluoratomer. Da B hører til gruppe IIIA (13), mangler den ikke-delte elektroner og danner fire kovalente bindinger, og dens CF er (3-4-0 = -1). På den anden side, for F, et element i gruppe VIIA (17), er dens CF (7-6-1 = 0).
For at bestemme ladningen af ionen eller molekylet er det nok at tilføje den individuelle CF af de atomer, der komponerer den: (1 (-1) + 4 (0) = -1).
CF for B har dog ingen reel betydning; det vil sige, at den højeste elektrondensitet ikke ligger på den. I virkeligheden fordeles denne elektrondensitet mod de fire atomer i F, et element, der er meget mere elektronegativt end B.
BeHto (berylliumhydrid)
Berylliumatomet tilhører gruppe IIA (2), danner to bindinger og mangler igen ikke-delte elektroner. CF'erne for Be og H er således:
CFVære= 2-2-0 = 0
CFH= 1-1-0 = 0
BeH belastningto= 1 (0) + 2 (0) = 0
CO (kulilte)
Dens Lewis-struktur kan repræsenteres som: C20: (selvom den har andre resonansstrukturer). Gentagelse af CF-beregningen, denne gang for C (i gruppe IVA) og O (i gruppe VIA), har vi:
CFC= 4-3-2 = -1
CFELLER= 6-3-2 = +1
Dette er et eksempel, hvor formelle afgifter ikke svarer til elementernes art. O er mere elektronegativ end C og bør derfor ikke have et positivt.
De andre strukturer (C = O og (+)CO(-)), selvom de overholder den sammenhængende tildeling af ladninger, overholder de ikke oktetreglen (C har mindre end otte valenselektroner).
NH4+ (ammoniumion), NH3 og NHto- (amidion)
jo flere elektroner N deler, jo mere positivt er dets CF (selv ammoniumionen, da den ikke har energitilgængelighed til at danne fem bindinger).
På samme måde som beregningerne for N i ammoniumionen, ammoniak- og amidionen har vi så:
CF = 5-4-0 = +1 (NH4+)
CF = 5-3-2 = 0 (NH3)
Og endelig:
CF = 5-2-4 = -1 (NHto-)
Det vil sige i NHto- N har fire ikke-delte elektroner og deler dem alle, når den danner NH4+. CF for H er lig med 0 og derfor gemmes din beregning.
Referencer
- James. (2018). En nøglefærdighed: Sådan beregnes formel afgift. Hentet den 23. maj 2018 fra: masterorganicchemistry.com
- Dr. Ian Hunt. Institut for Kemi, University of Calgary. Formelle afgifter. Hentet den 23. maj 2018 fra: chem.ucalgary.ca
- Formelle afgifter. [PDF]. Hentet den 23. maj 2018 fra: chem.ucla.edu
- Jeff D. Cronk. Formel afgift. Hentet den 23. maj 2018 fra: guweb2.gonzaga.edu
- Whitten, Davis, Peck & Stanley. Kemi. (8. udgave). CENGAGE Learning, s 268-270.
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave., S. 38). Mc Graw Hill.
- Monica Gonzalez. (10. august 2010). Formel afgift. Hentet den 23. maj 2018 fra: quimica.laguia2000.com


Endnu ingen kommentarer