
Cyclobutan struktur, egenskaber, anvendelser og syntese

Det cyclobutan er et carbonhydrid bestående af en cycloalkan med fire carbonatomer, hvis molekylformel er C4H8. Det kan også kaldes tetramethylen, i betragtning af at de er fire CH-enhederto der udgør en ring med firkantet geometri, selvom navnet cyclobutan er mere accepteret og kendt.
Ved stuetemperatur er det en farveløs, brandfarlig gas, der brænder med en lys flamme. Dens mest primitive anvendelse er som en varmekilde, når den brændes; Imidlertid omfatter dens strukturelle base (firkanten) dybe biologiske og kemiske aspekter og samarbejder på en bestemt måde med egenskaberne af disse forbindelser..
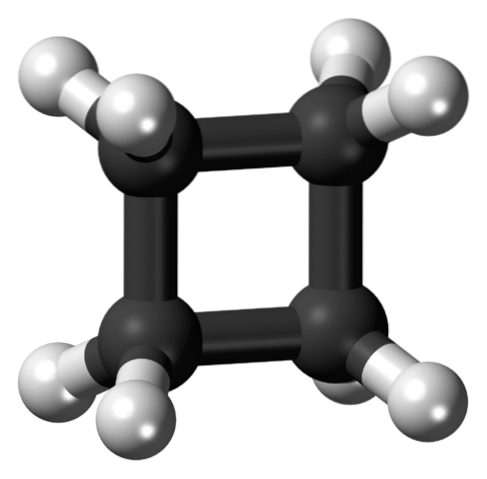
Det øverste billede viser et cyclobutanmolekyle med en firkantet struktur. I det næste afsnit forklarer vi, hvorfor denne konformation er ustabil, da dens links er spændte..
Efter cyclopropan er det den mest ustabile cycloalkan, da jo mindre ringstørrelse, jo mere reaktiv vil den være. Ifølge dette er cyclobutanen mere ustabil end pentan- og hexan-cyklussen. Det er dog nysgerrig at i dets derivater være vidne til en kerne eller et firkantet hjerte, som, som det ses, er dynamisk.
Artikelindeks
- 1 Struktur af cyclobutan
- 1.1 Sommerfugl eller rynket konformation
- 1.2 Intermolekylære interaktioner
- 2 egenskaber
- 2.1 Fysisk udseende
- 2.2 Molekylær masse
- 2.3 Kogepunkt
- 2.4 Smeltepunkt
- 2.5 Flammepunkt
- 2.6 Opløselighed
- 2.7 Tæthed
- 2.8 Dampdensitet
- 2.9 Damptryk
- 2.10 Brydningsindeks
- 2.11 Enthalpi af forbrændingen
- 2.12 Formationsvarme
- 3 Syntese
- 4 anvendelser
- 5 Referencer
Struktur af cyclobutan
I det første billede blev cyklobutans struktur nærmet sig som en simpel forkullet og hydrogeneret firkant. Imidlertid lider orbitalerne i dette perfekte firkant et alvorligt twist fra deres oprindelige vinkler: de er adskilt med en vinkel på 90 ° sammenlignet med 109,5 ° for et carbonatom med SP-hybridisering.3 (vinklet stress).
Kulstofatomer sp3 de er tetraedriske, og for nogle tetraedre ville det være svært at bøje deres orbitaler så meget for at skabe en 90º vinkel; men det ville være endnu mere for kulhydrater med SP-hybridiseringerto (120º) og sp (180º) afviger deres oprindelige vinkler. Af denne grund har cyclobutan sp carbonatomer3 i det væsentlige.
Også brintatomer er meget tæt på hinanden, formørket i rummet. Dette resulterer i en stigning i sterisk hindring, som svækker den formodede firkant på grund af dens høje torsionsspænding..
Derfor gør vinkel- og torsionsspændinger (indkapslet i udtrykket 'ringspænding') denne konformation ustabil under normale forhold..
Cyclobutanmolekylet vil søge at reducere begge spændinger, og for at opnå dette vedtager det, hvad der er kendt som sommerfugl eller puckered konformation..
Sommerfugl eller rynket konformation
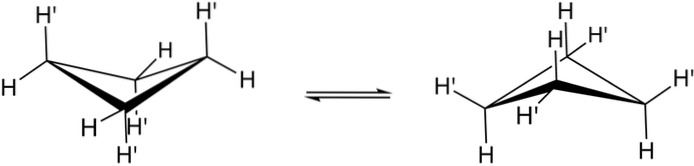
De sande konformationer af cyclobutan er vist ovenfor. I dem falder vinkel- og torsionsspændingerne; da, som det kan ses, nu ikke alle hydrogenatomer er overskyggede. Der er dog en energiomkostning: vinklen på dens led skærpes, det vil sige den falder fra 90 til 88º.
Bemærk, at det kan sammenlignes med en sommerfugl, hvis trekantede vinger består af tre kulstofatomer; og den fjerde, placeret i en vinkel på 25 ° i forhold til hver vinge. De tovejspile indikerer, at der er en ligevægt mellem begge konformere. Det er som om sommerfuglen gik ned og løftede sine vinger.
I cyclobutanderivater forventes der på den anden side at blive klappet meget langsommere og fysisk hindret..
Intermolekylære interaktioner
Antag, at du glemmer firkanterne et øjeblik, og de erstattes af kulsyreholdige sommerfugle i stedet. Disse i deres klappning kan kun holdes sammen i væsken af Londons spredningskræfter, som er proportionale med arealet af deres vinger og deres molekylære masse..
Ejendomme
Fysisk fremtoning
Farveløs gas.
Molekylær masse
56,107 g / mol.
Kogepunkt
12,6 ° C Derfor kunne det under kolde forhold principielt håndteres som enhver væske; med den eneste detalje, at det ville være meget ustabilt, og dets dampe stadig ville udgøre en risiko, der skal tages i betragtning.
Smeltepunkt
-91 ° C.
antændelsespunkt
50 ° C lukket glas.
Opløselighed
Uopløselig i vand, hvilket ikke er overraskende i betragtning af dets ikke-polære natur; men det er let opløseligt i alkoholer, ether og acetone, som er mindre polære opløsningsmidler. Det forventes at være opløseligt (dog ikke rapporteret) logisk i apolære opløsningsmidler, såsom carbontetrachlorid, benzen, xylen osv..
Massefylde
0.7125 ved 5 ° C (i forhold til 1 af vandet).
Dampmassefylde
1,93 (i forhold til 1 i luften). Dette betyder, at den er tættere end luft, og medmindre der er strømme, vil dens tendens ikke være at stige..
Damptryk
1.180 mmHg ved 25 ° C.
Brydningsindeks
1.3625 ved 290ºC.
Enthalpi af forbrænding
-655,9 kJ / mol.
Dannelsesvarme
6,6 Kcal / mol ved 25 ° C.
Syntese
Cyclobutan syntetiseres ved hydrogenering af cyclobutadien, hvis struktur er næsten den samme, med den eneste forskel, at den har en dobbeltbinding; og derfor er det endnu mere reaktivt. Dette er måske den enkleste syntetiske vej til at opnå den, eller i det mindste kun til den og ikke til et derivat.
I råolie er det usandsynligt, at det opnås, da det ender med at reagere på en sådan måde, at det bryder ringen og danner linjekæden, det vil sige n-butan.
En anden metode til opnåelse af cyclobutan består i at slå ultraviolet stråling på ethylenmolekylerne, CHto= CHto, som dæmpes. Denne reaktion foretrækkes fotokemisk, men ikke termodynamisk:
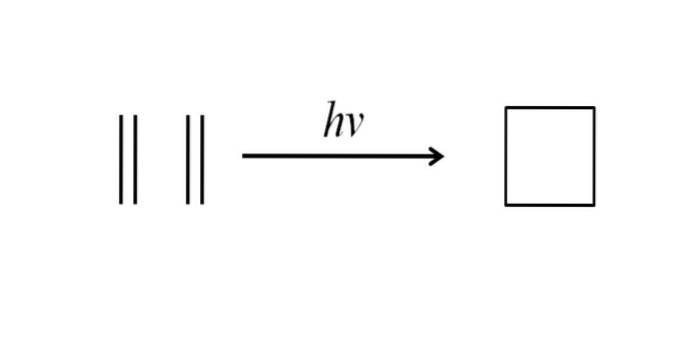
Ovenstående billede opsummerer meget godt, hvad der blev sagt i ovenstående afsnit. Hvis man i stedet for ethylen for eksempel havde to alkener, ville man få en substitueret cyclobutan; eller hvad er det samme, et derivat af cyclobutan. Faktisk er mange derivater med interessante strukturer blevet syntetiseret ved denne metode..
Andre derivater involverer imidlertid en række komplicerede syntetiske trin. Derfor er cyclobutaner (som deres derivater kaldes) genstand for undersøgelse af organiske synteser..
Ansøgninger
Cyclobutan alene har ingen anden anvendelse end at tjene som varmekilde; men dets derivater går ind i indviklet terræn i organisk syntese med anvendelser inden for farmakologi, bioteknologi og medicin. Uden at fordybe sig i alt for komplekse strukturer er penitrems og grandisol eksempler på cyclobutaner.
Cyclobutaner har generelt egenskaber, der er gavnlige for metabolismen af bakterier, planter, marine hvirvelløse dyr og svampe. De er biologisk aktive, og det er derfor, deres anvendelser er meget varierede og vanskelige at specificere, da hver enkelt har sin særlige virkning på visse organismer..
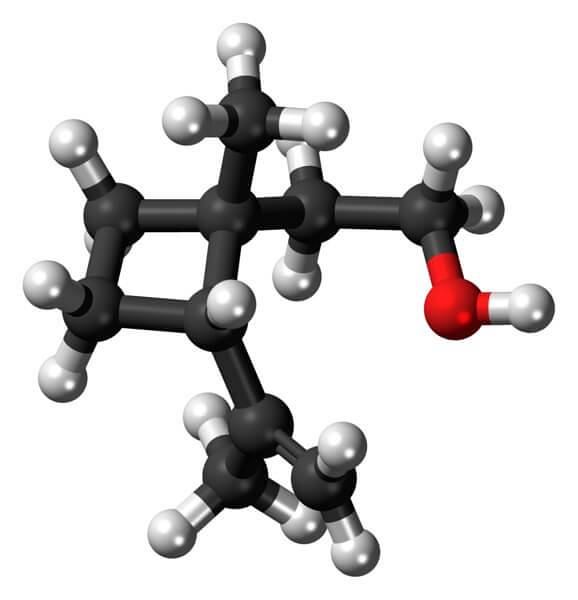
Grandisol er for eksempel et feromon fra sneglen (en slags bille). Ovenfor og til sidst vises dens struktur betragtet som en monoterpen med en firkantet base af cyclobutan.
Referencer
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Graham Solomons, T.W .; Craig B. Fryhle. (2011). Organisk kemi. (elleveth udgave). Wiley.
- Wikipedia. (2019). Cyclobutan. Gendannet fra: en.wikipedia.org
- PubChem. (2019). Cyclobutan. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Peiris Nicole. (2015, 29. november). Fysiske egenskaber af cycloalkaner. Kemi LibreTexts. Gendannet fra: chem.libretexts.org
- Wiberg B. Kenneth. (2005). Cyclobutan-fysiske egenskaber og teoretiske studier. Institut for Kemi, Yale University.
- Klement Foo. (s.f.). Cyclobutaner i organisk syntese. Gendannet fra: scripps.edu
- Myers. (s.f.). Cyclobutanesyntese. Chem 115. Gendannet fra: hwpi.harvard.edu



Endnu ingen kommentarer