
Calcium cyklus karakteristika, stadier og betydning

Det calciumcyklus Det er cirkulation og opbevaring af dette element på Jorden, der omfatter levende væsener, litosfæren og hydrosfæren. Det er en sedimentær biogeokemisk cyklus, hvor calcium cirkulerer som et blødt jordalkalimetal uden et gasformigt trin..
Stadiet med den største cirkulation af calcium er det biologiske, da det forbruges af levende væsener og bruges i deres strukturer og stofskifte. Når levende væsener er døde, integreres calcium igen i det fysiske miljø som en del af jorden og havbunden.
Der er omfattende aflejringer af skaller og knogler, især på havbunden og i de store søer. Disse strukturer blandes med sedimenter, og over millioner af år er de dækket af successive lag.
De nederste lag af sedimenter udsættes for højtryksdannende sedimentære klipper, der derefter udsættes for overfladen på grund af jordiske geologiske processer. Eksponerede klipper udsættes for forvitring og erosion og frigiver calcium, der integreres i jorden eller skylles væk af vand..
I jorden absorberes det hovedsageligt af planterødderne og i havet af planteplankton og andre organismer. Calcium bruges til forskellige strukturelle og metaboliske formål, for eksempel fremstilling af skaller.
Calciumcyklussen er vigtig, da den gør det muligt for dette element at være tilgængeligt i sine forskellige faser og udføre forskellige funktioner. At være en del af strukturen i levende organismer, deltager således i dannelsen af jordbaseret lettelse, regulerer pH i jord og vand og fungerer som råmateriale til den menneskelige industri.
Artikelindeks
- 1 Generelle egenskaber
- 1.1 - Calcium
- 1.2 - Din cyklus
- 2 faser af calciumcyklussen
- 2.1 - Geologisk fase
- 2.2 - Hydrologisk stadium
- 2.3 - Biologisk stadium
- 3 Vigtighed
- 3.1 - Væsentligt element for livet
- 3.2 - Mad og sundhed
- 3.3 - Perlerne
- 3.4 - Industriel råvare
- 3,5 - pH-regulering af jord
- 3.6 - Kalkholdigt vand eller hårdt vand
- 3.7 - Kalkholdige huler og akviferer
- 4 Referencer
Generelle egenskaber
- Calcium
Calcium (Ca) er et jordalkalisk blødt metal med atomnummer 20 og atommasse 40.078, hvis normale tilstand er fast. Danner oxider, der fungerer som stærke baser og reagerer voldsomt, når de er i kontakt med syrer.
- Din cyklus
Calcium opfylder en sedimentær biogeokemisk cyklus, da den mangler en gasfase, og de største reserver er i litosfæren. Det er tæt knyttet til kulstof-, vand- og fosforcyklusser.
Rock erosion
Cyklussen udvikler sig fra forvitring og erosion af kalkholdige klipper, der frigiver det calcium, der er deponeret i jorden. Ligeledes kan det transporteres opløst i afstrømningsvand til floder, søer og oceaner..
Når regnvand kommer i kontakt med atmosfærisk CO2, danner det H2CO3, der opløser kalksten og frigiver Ca2 + og HCO3-. På den anden side forvandler CO2 transporteret af regnvand det uopløselige carbonat til opløseligt bicarbonat..
Absorption og brug af levende væsener
Calcium (Ca2 +) i jorden absorberes af planter og i vandområder af vandorganismer. I kroppen opfylder calcium forskellige metaboliske funktioner, og når organismer dør, vender det tilbage til det fysiske miljø, der transporteres af afstrømningsvand til floder, søer og oceaner..
Klippedannelse
Dyreskeletter (indvendige og udvendige eller skaller) deponeres på havbunden som en del af sedimenterne. Sedimentlagene er dækket og komprimeret over millioner af år til dannelse af kalkholdige klipper..

Senere diastrofiske processer (brud og opadgående bevægelser af jordskorpen) udsætter klipperne for overfladen. På denne måde lukkes cyklussen, fordi klipperne igen forvitrer (klimatiske elementers handling) og er forvitret og eroderet.
Stadier af calciumcyklussen
De faser, som calcium går igennem i dets opbevarings- og cirkulationscyklus, bestemmes af de rum, hvor disse processer forekommer. Disse er skorpen og en del af jordens kappe (litosfæren), vandområder (hydrosfæren) og levende organismer.
- Geologisk fase
I det geologiske stadium, opdelt i skorpen og kappen, er det her, hvor den største mængde calciumlagring findes. Calcium er det femte mest forekommende element i lithosfæren og udgør 3,5% af jordskorpen.
Det findes at være en del af klipper som kalksten, dolomit, marmel og marmor, mens kalksten og dolomitter danner enorme bjergkæder over hele planeten. På samme måde er det en del af andre naturlige forbindelser som gips og alabaster (calciumsulfat).
I mineralform opnås det som calciumcarbonat (CaCO3) fra calcit, dolomit og andre krystallinske former såsom aragonit..
Kalksten
Det er en meget rigelig type sedimentær sten, der stammer fra gamle marine eller lakustrinske aflejringer (søer), der består af 99% calciumcarbonat. Disse klipper danner vandrette lag eller deformeres af diastrofiske bevægelser, og deres forvitring giver anledning til neutral til basisk jord (pH 7 eller højere), rig på calcium..
Dolomit
Den består af en sedimentær klippe dannet i lavvandede marine aflejringer ved en kemisk substitutionsreaktion. I dette tilfælde deltager magnesium i mineralkonformationen og danner dolomit eller calciummagnesiumcarbonat (CaMg (CO3) 2).
Margas
De er sedimentære klipper dannet af 1/3 til 2/3 af calciumcarbonat og resten af ler. Disse klipper vedvarer i tørre områder, da de er meget modtagelige for vanderosion..
Marmor
Hvis kalksten er udsat for høje temperaturer og tryk i dybe lag af jordskorpen, dannes der marmor. Dette er en meget kompakt metamorf sten med en høj grad af krystallisation.
- Hydrologisk stadium
Calcium opløses i floder, søer og oceaner som calciumchlorid (som den mest almindelige ion i dette medium) og calciumcarbonat. I havene er calciumcarbonat (CaCO3) stabilt i dybder på mindre end 4.500 m.
Calcium i dette medium findes i levende organismer og i kalkstenaflejringer på havbunden. Dette er dybdegrænsen for carbonatkompensation, hvorefter CaCO3 opløses og ikke danner kalkaflejringer..
- Biologisk stadium

På dette stadium når calciumcyklussen sin største cirkulation og er vital for levende væsener, fordi den som en Ca2 + -ion er en del af cellemembranernes udvekslingsmekanismer. På den anden side er det en væsentlig bestanddel af knogler, tænder, æggeskaller og skaller..

På denne måde cirkulerer calcium i biosfæren, og når organismer dør, vender det tilbage til sedimenterne for at danne nye klipper over tid..
Mennesket
Et fremragende element i den biologiske fase af calciumcyklussen er menneskets rolle i at bruge dette element som råmateriale. Dette element ekstraheres, transporteres og bruges i store mængder på forskellige måder.
I åbne miner udvindes kalksten for at bruge det som et konstruktionselement eller til at male det og bruge det som et industrielt råmateriale. Skallerne er også formalet for at forberede gødning og andre produkter.
Skaller af Foraminifera og bløddyr
Skallene på disse dyr er dannet af calciumcarbonat, krystalliseret som calcit eller aragonit. Disse er to mineralformer med den samme sammensætning (CaCO3), men som krystalliserer forskelligt..
Bløddyr danner deres skaller fra en flydende form af calcium udskilt af specialiserede celler. Skallets inderste lag er nacren dannet af aragonitkrystaller blandet med conchiolinproteinet.
Betydning
Cirkulationen af calcium, der danner sin karakteristiske cyklus, er afgørende for at gøre dette element tilgængeligt for levende væsener. Takket være de processer, der frigiver calcium fra klipper og får det til at cirkulere, eksisterer livet, som vi kender det.
- Væsentligt element for livet
Calcium er essentielt for livet, da det både er et strukturelt og et metabolisk element. Strukturelt er det en grundlæggende del i konformationen af både indre og eksterne skeletter.
Hos knogledyr er calcium hovedkomponenten i knoglerne (indre skelet), også i tænderne. I foraminifera (protister) og bløddyr (snegle og muslinger) er det den vigtigste ingrediens til dannelsen af det ydre skelet, det vil sige skaller.
Metabolisme
Calcium er et transportmiddel i cellemembraner, så det spiller en vigtig rolle i stofskiftet. I cellemembraner er der calciumkanaler, der tillader passiv indgang af dette element i celler.
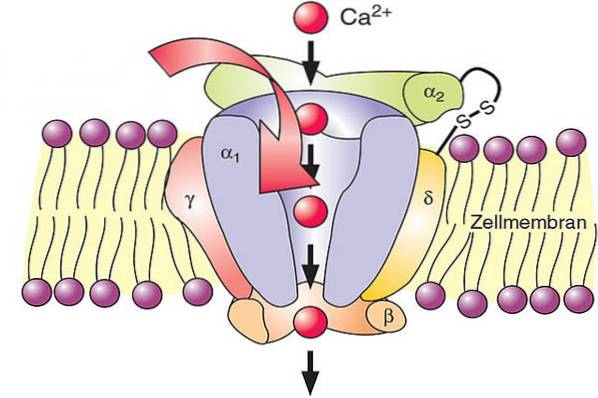
Dette regulerer forholdet mellem calciumkoncentrationer mellem indersiden og ydersiden af cellen, hvilket aktiverer forskellige metaboliske processer. For eksempel er disse mekanismer afgørende for funktionen af nervesystemet og muskelsystemet og spiller derfor en relevant rolle i hjertefunktionen..
- Mad og sundhed
Fra det menneskelige synspunkt gør calciumcyklussen det muligt at gøre dette element tilgængeligt for mad og menneskers sundhed. Frem for alt er det vigtigt i produktionen og tilberedningen af mejeriprodukter til børn..
Tilsvarende anvendes dets indtagelse til medicinske formål til behandling af calciummangelsygdomme, såsom osteoporose. Denne knoglesvækkende sygdom er særlig alvorlig hos ældre mennesker, især hos kvinder..
- Perlerne
Når et fremmedlegeme invaderer østersen, dækker det det med perlemor, og derved dannes en perle. Perler når høje værdier på smykkemarkedet verden over.
- Industriel råvare
Kalksten bruges industrielt til forskellige formål, for eksempel fremstilling af cement. Disse sten bruges også direkte som et byggemateriale på grund af deres lette udskæring..
Derudover anvendes calcium som deoxideringsmiddel og reduktionsmiddel i forskellige processer, især i den metallurgiske industri..
Citron
Som kalk, også kaldet bygningskalk, er de calciumoxider, der bruges som bindemiddel og belægning i konstruktionen. På samme måde bruges det til fremstilling af sæbe, papir, glas, gummi og til lædergarvning..
Ligeledes har den forskellige anvendelser i fødevareindustrien og i vandbehandling. Mens det er slækket kalk eller calciumhydroxid, bruges det også i industrien og landbruget..
- Jord pH-regulering
Indholdet af calciumoxider i jorden påvirker reguleringen af pH. I landbruget bruges kalk som en landbrugsændring for at reducere jordens surhedsgrad og også som gødning.
- Kalkholdigt vand eller hårdt vand
Når vand cirkulerer i miljøer, der er rige på calcium og magnesium, opløses det salte af disse grundstoffer og er kendt som kalkholdigt eller hårdt vand. Vandkvalitetsgrænsen er 120 mg CaCO3 / liter, over hvilken vandet anses for at være hårdt.
Vand med højt calciumindhold kan forårsage sundhedsmæssige problemer, især relateret til det kardiovaskulære system. Derudover producerer hårdt vand kalkholdige aflejringer i rørene, der forhindrer cirkulationen..
- Kalkholdige huler og akviferer
I kalkholdige klipper danner vanderosion ofte underjordiske hulesystemer med interessante interne konfigurationer. Blandt disse skiller dannelsen af stalaktitter og stalagmitter sig ud på grund af calciumcarbonataflejringer fra lækagerne i lofterne i disse huler..
Disse kalkholdige systemer opfylder også funktionen til filtrering af grundvandet på grund af dets porøsitet og danner grundvandsmagasiner..
Referencer
- Calow, P. (red.) (1998). Encyclopædi for økologi og miljøledelse.
- Christopher R. og Fielding, C.R. (1993). En gennemgang af nyere forskning inden for fluvial sedimentologi. Sedimentær geologi.
- Margalef, R. (1974). Økologi. Omega-udgaver.
- Miller, G. og TYLER, J.R. (1992). Økologi og miljø. Grupo Editorial Iberoamérica S.A. af C.V.
- Odum, E.P. og Warrett, G.W. (2006). Grundlæggende om økologi. Femte udgave. Thomson.



Endnu ingen kommentarer