
Calciumphosphat (Ca3 (PO4) 2) struktur, egenskaber og anvendelser

Det calciumphosphat er et uorganisk og tertiært salt, hvis kemiske formel er Ca3(PO4)to. Formlen siger, at sammensætningen af dette salt er henholdsvis 3: 2 for calcium og phosphat. Dette kan ses direkte på billedet nedenfor, hvor kationen Ca vises.to+ og anion PO43-. For hver tre Cato+ der er to PO43- interagerer med dem.
På den anden side henviser calciumphosphat til en række salte, der varierer afhængigt af Ca / P-forholdet, samt graden af hydrering og pH. Faktisk er der mange typer calciumphosphater, der findes og kan syntetiseres. Imidlertid henviser calciumfosfat efter nomenklaturen til punkt og prikke kun til tricalcium, den førnævnte.

Alle calciumphosphater, inklusive Ca3(PO4)to, de er helt hvide med svagt gråtoner. De kan være granulære, fine, krystallinske og have partikelstørrelser på omkring mikron; og endda nanopartikler af disse fosfater er blevet fremstillet, med hvilke biokompatible materialer til knogler er designet.
Denne biokompatibilitet skyldes det faktum, at disse salte findes i tænderne og kort sagt i pattedyrs knoglevæv. F.eks. Er hydroxyapatit et krystallinsk calciumphosphat, som igen interagerer med en amorf fase af det samme salt..
Dette betyder, at der er amorfe og krystallinske calciumphosphater. Af den grund er det ikke overraskende mangfoldigheden og de mange muligheder, når man syntetiserer materialer baseret på calciumphosphater; materialer, hvis egenskaber hver dag er flere forskere interesserede over hele verden for at fokusere på restaurering af knogler.
Artikelindeks
- 1 Struktur af calciumphosphat
- 1.1 Amorft calciumphosphat
- 1.2 Resten af familien
- 2 Fysiske og kemiske egenskaber
- 2.1 Navne
- 2.2 Molekylvægt
- 2.3 Fysisk beskrivelse
- 2.4 Smag
- 2.5 Smeltepunkt
- 2.6 Opløselighed
- 2.7 Tæthed
- 2.8 Brydningsindeks
- 2.9 Standard dannelse entalpi
- 2.10 Opbevaringstemperatur
- 2,11 pH
- 3 Træning
- 3.1 Calciumnitrat og ammoniumhydrogenphosphat
- 3.2 Calciumhydroxid og fosforsyre
- 4 anvendelser
- 4.1 I knoglevæv
- 4.2 Biokeramiske cement
- 4.3 Læger
- 4.4 Andre
- 5 Referencer
Struktur af calciumphosphat
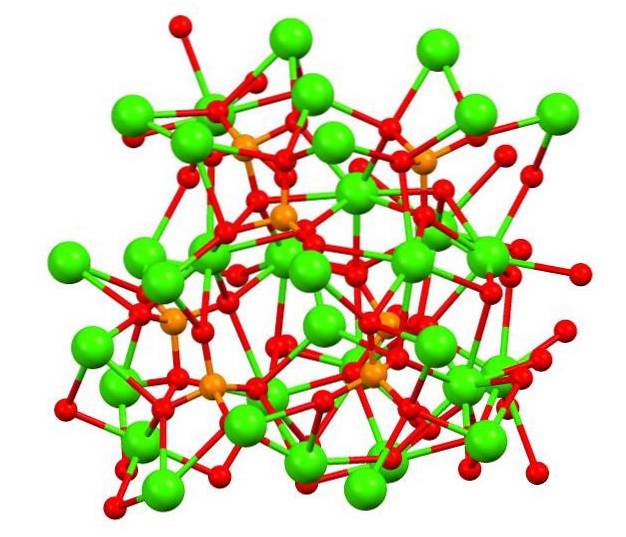
Det øverste billede viser strukturen af tribasic calico phosphate i det mærkelige mineral whitlockite, som kan indeholde magnesium og jern som urenheder..
Selvom det ved første øjekast kan virke komplekst, er det nødvendigt at præcisere, at modellen antager kovalente interaktioner mellem iltatomerne i fosfater og metalcentrene i calcium..
Som repræsentation er det gyldigt, men interaktionerne er elektrostatiske; kationerne Cato+ er tiltrukket af PO anioner43- (ACto+- O-PO33-). Med dette i tankerne forstås det, hvorfor calcium (grønne sfærer) i billedet er omgivet af de negativt ladede iltatomer (røde sfærer).
Fordi der er så mange ioner, efterlader det ikke et symmetrisk arrangement eller mønster synligt. Ca3(PO4)to vedtager ved lave temperaturer (T<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4)to (β-TCP).
På den anden side omdannes det til polymorf α-Ca ved høje temperaturer3(PO4)to (α-TCP), hvis enhedscelle svarer til et monoklinisk krystalsystem. Ved endnu højere temperaturer kan polymorf α'-Ca også dannes.3(PO4)to, som har en sekskantet krystallinsk struktur.
Amorft calciumphosphat
Krystalstrukturer er blevet nævnt for calciumphosphat, som man kan forvente af et salt. Imidlertid er det i stand til at udvise uordnede og asymmetriske strukturer, der er mere knyttet til en type "calciumphosphatglas" end til krystaller i den strenge betydning af dets definition..
Når dette sker, siges calciumphosphat at have en amorf struktur (ACP, amorft calciumphosphat). Flere forfattere peger på denne type struktur som ansvarlige for Ca's biologiske egenskaber3(PO4)to i knoglevæv, dets reparation og biomimetisering er mulig.
Ved at belyse dens struktur ved kernemagnetisk resonans (NMR) er tilstedeværelsen af OH-ioner blevet fundet- og HPO4to- i AVS. Disse ioner dannes ved hydrolyse af et af phosphaterne:
PO43- + HtoELLER <=> HPO4to- + Åh-
Som et resultat bliver den sande struktur af ACP mere kompleks, hvis sammensætning af dets ioner er repræsenteret med formlen: Ca9(PO4)6-x(HPO4)x(OH)x. 'X' angiver graden af hydrering, da hvis x = 1, så vil formlen være som: Ca9(PO4)5(HPO4) (OH).
De forskellige strukturer, som ACP kan have, afhænger af Ca / P molforholdene; det vil sige de relative mængder calcium og phosphat, der ændrer hele deres resulterende sammensætning.
Resten af familien
Calciumphosphater er faktisk en familie af uorganiske forbindelser, som igen kan interagere med en organisk matrix.
De andre fosfater opnås "ganske enkelt" ved at ændre anionerne, der ledsager calcium (PO43-, HPO4to-, HtoPO4-, Åh-) såvel som typen af urenheder i det faste stof. Således kan op til elleve calciumphosphater eller mere, hver med sin egen struktur og egenskaber, være naturligt eller kunstigt stammer..
Nogle fosfater og deres respektive kemiske strukturer og formler vil blive nævnt nedenfor:
-Calciumhydrogenphosphatdihydrat, CaHPO4∙ 2HtoO: monoklinisk.
-Calciumdihydrogenphosphatmonohydrat, Ca (HtoPO4)to∙ HtoEller: triklinik.
-Vandfrit disyrephosphat, Ca (HtoPO4)to: triklinik.
-Octacalciumhydrogenphosphat (OCP), Ca8Hto(PO4)6: triklinik. Det er en forløber i syntesen af hydroxyapatit.
-Hydroxyapatit, Ca5(PO4)3OH: sekskantet.
Fysiske og kemiske egenskaber
Navne
-Calciumphosphat
-Tricalciumphosphat
-Tricalcium diphosphat
Molekylær vægt
310,74 g / mol.
Fysisk beskrivelse
Det er et lugtfrit hvidt fast stof.
Smag
Smagløs.
Smeltepunkt
1670 ºK (1391 ºC).
Opløselighed
-Næsten uopløselig i vand.
-Uopløselig i ethanol.
-Opløselig i fortyndet saltsyre og salpetersyre.
Massefylde
3,14 g / cm3.
Brydningsindeks
1.629
Standard dannelse entalpi
4126 kcal / mol.
Stuetemperatur
2-8 ºC.
pH
6-8 i en vandig suspension af 50 g / l calciumphosphat.
Uddannelse
Calciumnitrat og ammoniumhydrogenphosphat
Der er adskillige metoder til at producere eller danne calciumphosphat. En af dem består af en blanding af to salte, Ca (NO3)to∙ 4HtoO og (NH4)toHPO4, tidligere opløst i henholdsvis absolut alkohol og vand. Det ene salt tilvejebringer calcium, og det andet giver phosphat.
Fra denne blanding udfældes ACP, som derefter udsættes for opvarmning i en ovn ved 800 ° C i 2 timer. Som et resultat af denne procedure opnås β-Ca3(PO4)to. Ved omhyggelig kontrol af temperaturer, omrøring og kontakttider kan dannelsen af nanokrystaller forekomme.
At danne polymorf α-Ca3(PO4)to det er nødvendigt at opvarme fosfatet over 1000 ° C. Denne opvarmning udføres i nærværelse af andre metalioner, som stabiliserer denne polymorfe tilstrækkeligt, så den kan anvendes ved stuetemperatur; det vil sige, det forbliver i en stabil metatilstand.
Calciumhydroxid og fosforsyre
Calciumphosphat kan også dannes ved at blande opløsningerne af calciumhydroxid og phosphorsyre til dannelse af en syre-base-neutralisering. Efter en halv dags modning i moderludene og deres passende filtrering, vask, tørring og sigtning opnås et granulært amorft phosphatpulver, ACP..
Dette ACP-reaktionsprodukt ved høje temperaturer transformeres i henhold til følgende kemiske ligninger:
2Ca9(HPO4) (PO4)5(OH) => 2Ca9(StoELLER7)0,5(PO4)5(OH) + HtoO (ved T = 446,60 ° C)
2Ca9(StoELLER7)0,5(PO4)5(OH) => 3Ca3(PO4)to + 0,5HtoO (ved T = 748,56 ° C)
På denne måde opnås β-Ca3(PO4)to, dens mest almindelige og stabile polymorf.
Ansøgninger
I knoglevæv
Ca3(PO4)to det er den vigtigste uorganiske bestanddel af knogleaske. Det er en komponent i udskiftning af knogletransplantationer, hvilket forklares ved dets kemiske lighed med de mineraler, der findes i knoglen.
Calciumphosphatbiomaterialer bruges til at rette knogledefekter og i belægningen af titanmetalproteser. Calciumphosphat afsættes på dem, isolerer dem fra miljøet og bremser titankorrosionsprocessen..
Calciumphosphater, herunder Ca3(PO4)to, De bruges til at fremstille keramiske materialer. Disse materialer er biokompatible og bruges i øjeblikket til at genoprette alveolært knogletab som følge af periodontal sygdom, endodontiske infektioner og andre tilstande..
De bør dog kun bruges til at fremskynde reparation af periapikal knogle i områder, hvor der ikke er nogen kronisk bakteriel infektion..
Calciumphosphat kan bruges til at reparere knogledefekter, når et autogent knogletransplantat ikke kan bruges. Det kan bruges alene eller i kombination med en biologisk nedbrydelig og resorberbar polymer, såsom polyglycolsyre.
Biokeramiske cement
Calciumphosphatcement (CPC) er et andet biokeramisk middel, der anvendes til reparation af knoglevæv. Det fremstilles ved at blande pulveret af forskellige typer calciumphosphater med vand og danne en pasta. Pastaen kan injiceres eller monteres på knogledefekten eller hulrummet.
Cementer støbes, gradvis resorberes og erstattes af nydannet knogle.
Læger
-Ca3(PO4)to Det er et basisk salt, så det bruges som et antacida til at neutralisere overskydende halsbrand og øge pH. I tandpastaer tilvejebringer det en kilde til calcium og fosfat for at lette processen med remineralisering af tænderne og knoglehæmostase.
-Det bruges også som et ernæringstilskud, selvom den billigste måde at levere calcium på er ved hjælp af dets carbonat og citrat..
-Calciumphosphat kan anvendes til behandling af tetany, latent hypokalcæmi og vedligeholdelsesbehandling. Derudover er det nyttigt ved calciumtilskud under graviditet og amning..
-Det bruges til behandling af forurening med radioaktive isotoper radium (Ra-226) og strontium (Sr-90). Calciumphosphat blokerer absorptionen af radioaktive isotoper i fordøjelseskanalen og begrænser dermed skaden forårsaget af dem.
Andre
-Calciumphosphat anvendes som foder til fugle. Derudover bruges det i tandpastaer til at kontrollere tandsten..
-Det bruges som et antiklumpningsmiddel, for eksempel for at forhindre, at bordsalt komprimeres.
-Det fungerer som blegemiddel til mel. I mellemtiden forhindrer det i svinefedt uønsket farvning og forbedrer tilstanden af stegning..
Referencer
- Tung M.S. (1998) Calciumphosphater: struktur, sammensætning, opløselighed og stabilitet. I: Amjad Z. (red.) Calciumphosphater i biologiske og industrielle systemer. Springer, Boston, MA.
- Langlang Liu, Yanzeng Wu, Chao Xu, Suchun Yu, Xiaopei Wu og Honglian Dai. (2018). "Syntese, karakterisering af nano-β-tricalciumphosphat og inhiberingen af hepatocellulære carcinomceller," Journal of Nanomaterials, bind. 2018, artikel-ID 7083416, 7 sider, 2018.
- Combes, Christ og Rey, Christian. (2010). Amorfe calciumphosphater: syntese, egenskaber og anvendelser i biomaterialer. Acta Biomaterialia, bind. 6 (nr. 9). pp. 3362-3378. ISSN 1742-7061
- Wikipedia. (2019). Tricalciumphosphat. Gendannet fra: en.wikipedia.org
- Abida et al. (2017). Tricalciumphosphatpulver: Forberedelse, karakterisering og komprimeringsevne. Mediterranean Journal of Chemistry 2017, 6 (3), 71-76.
- PubChem. (2019). Calciumphosphat. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Elsevier. (2019). Calciumphosphat. Science Direct. Gendannet fra: sciencedirect.com



Endnu ingen kommentarer