
Lov om bevarelse af stofeksperimenter og eksempler

Det lov om bevarelse af stof eller masse Det er en, der fastslår, at stof hverken skabes eller ødelægges i enhver kemisk reaktion. Denne lov er baseret på det faktum, at atomer er udelelige partikler i denne type reaktion; mens i atomreaktioner atomer fragmenterer, hvorfor kemiske reaktioner ikke overvejes.
Hvis atomer ikke ødelægges, skal antallet af atomer før og efter reaktionen holdes konstant, når et element eller en forbindelse reagerer; hvilket oversættes til en konstant mængde masse mellem de involverede reaktanter og produkter.
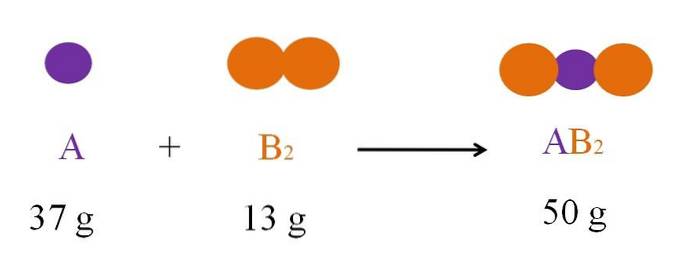
Dette er altid tilfældet, hvis der ikke er nogen lækage, der forårsager tab af materiale; men hvis reaktoren er lukket hermetisk, forsvinder intet atom, og derfor skal den ladede masse være lig med massen efter reaktionen.
Hvis produktet på den anden side er fast, vil dets masse være lig med summen af de reaktanter, der er involveret i dets dannelse. Det samme sker med flydende eller gasformige produkter, men det er mere tilbøjeligt til at begå fejl ved måling af deres resulterende masser..
Denne lov blev født af eksperimenter i de sidste århundreder og blev styrket af bidrag fra forskellige berømte kemikere, såsom Antoine Lavoisier..
Overvej reaktionen mellem A og Bto at danne ABto (øverste billede). I henhold til loven om bevarelse af stof er massen af ABto skal være lig med summen af masserne A og B.to, henholdsvis. Så hvis 37g A reagerer med 13g Bto, produkt ABto skal veje 50 g.
Derfor, i en kemisk ligning, massen af reaktanterne (A og B.to) skal altid være lig med produkternes masse (ABto).
Et eksempel, der meget ligner det netop beskrevne, er dannelsen af metaloxider, såsom rust eller rust. Rust er tungere end jern (selvom det måske ikke virker som det), da metallet reagerede med en masse ilt for at generere oxid.
Artikelindeks
- 1 Hvad er loven om bevarelse af stof eller masse??
- 1.1 Lavoisiers bidrag
- 2 Hvordan anvendes denne lov i en kemisk ligning?
- 2.1 Grundlæggende principper
- 2.2 Kemisk ligning
- 3 Eksperimenter, der beviser loven
- 3.1 Forbrænding af metaller
- 3.2 Frigivelse af ilt
- 4 eksempler (praktiske øvelser)
- 4.1 Nedbrydning af kviksølvmonoxid
- 4.2 Forbrænding af et magnesiumbånd
- 4.3 Calciumhydroxid
- 4.4 Kobberoxid
- 4.5 Dannelse af natriumchlorid
- 5 Referencer
Hvad er loven om bevarelse af stof eller masse??
Denne lov fastslår, at i en kemisk reaktion er massen af reaktanterne lig med produkternes masse. Loven udtrykkes i sætningen "materie er hverken skabt eller ødelagt, alt er transformeret", da det blev underkendt af Julius Von Mayer (1814-1878).
Loven blev udviklet uafhængigt af Mikhail Lamanosov i 1745 og af Antoine Lavoisier i 1785. Selvom Lamanosovs forskning arbejder om loven om bevarelse af masse forud for Lavoisiers, var de ikke kendt i Europa for at være skrevet på russisk..
Eksperimenterne udført i 1676 af Robert Boyle fik dem til at påpege, at når et materiale blev forbrændt i en åben beholder, steg materialet i vægt; måske på grund af en transformation, som materialet selv oplever.
Lavoisers eksperimenter med forbrænding af materialer i containere med begrænset luftindtag viste en vægtøgning. Dette resultat var i overensstemmelse med det, Boyle opnåede.
Lavoisiers bidrag
Lavoisiers konklusion var imidlertid en anden. Han troede, at der under forbrændingen blev ekstraheret en mængde masse fra luften, hvilket ville forklare den stigning i masse, der blev observeret i de materialer, der blev udsat for forbrænding..
Lavoiser mente, at metallenes masse forblev konstant under forbrændingen, og at faldet i forbrænding i lukkede beholdere ikke var forårsaget af et fald i et løst (ubrugt koncept), en formodet essens relateret til produktion af varme..
Lavoiser påpegede, at det observerede fald snarere skyldtes et fald i koncentrationen af gasser i de lukkede beholdere..
Hvordan anvendes denne lov i en kemisk ligning?
Loven om bevarelse af masse er af transcendental betydning i støkiometri, hvor sidstnævnte defineres som beregningen af de kvantitative forhold mellem reaktanter og produkter, der er til stede i en kemisk reaktion..
Principperne for støkiometri blev erklæret i 1792 af Jeremías Benjamin Richter (1762-1807), der definerede det som videnskaben, der måler de kvantitative proportioner eller masseforhold af de kemiske grundstoffer, der er involveret i en reaktion..
I en kemisk reaktion er der en modifikation af de stoffer, der deltager i den. Det bemærkes, at reaktanterne eller reaktanterne forbruges til oprindelsen af produkterne.
Under den kemiske reaktion er der brud på bindinger mellem atomerne såvel som dannelsen af nye bindinger; men antallet af atomer involveret i reaktionen forbliver uændret. Dette er hvad der er kendt som loven om bevarelse af materie.
Grundlæggende principper
Denne lov indebærer to grundlæggende principper:
-Det samlede antal atomer af hver type er lig i reaktanterne (før reaktionen) og i produkterne (efter reaktionen).
-Summen af de elektriske ladninger før og efter reaktionen forbliver konstant.
Dette skyldes, at antallet af subatomære partikler forbliver konstant. Disse partikler er neutroner uden elektrisk ladning, positivt ladede protoner (+) og negativt ladede elektroner (-). Så den elektriske ladning ændres ikke under en reaktion.
Kemisk ligning
Når det er sagt ovenfor, skal de grundlæggende principper respekteres, når de repræsenterer en kemisk reaktion gennem en ligning (som den i hovedbilledet). Den kemiske ligning bruger symboler eller repræsentationer af de forskellige grundstoffer eller atomer, og hvordan de grupperes i molekyler før eller efter reaktionen.
Følgende ligning vil blive brugt igen som et eksempel:
A + B.to => ABto
Abonnementet er et tal, der er placeret på højre side af elementerne (Bto og ABto) i sin nedre del, hvilket angiver antallet af atomer af et element til stede i et molekyle. Dette tal kan ikke ændres uden produktion af et nyt molekyle, der er forskelligt fra det oprindelige..
Den støkiometriske koefficient (1, for A og resten af arten) er et tal, der er placeret på venstre side af atomerne eller molekylerne, hvilket indikerer antallet af dem involveret i en reaktion.
I en kemisk ligning, hvis reaktionen er irreversibel, placeres en enkelt pil, der angiver reaktionens retning. Hvis reaktionen er reversibel, er der to pile i den modsatte retning. Til venstre for pilene er reagenserne eller reaktanterne (A og B.to), mens til højre er produkterne (ABto).
Svingende
At afbalancere en kemisk ligning er en procedure, der gør det muligt at svare antallet af atomer af de kemiske grundstoffer, der er til stede i reaktanterne, med produkterne.
Med andre ord skal antallet af atomer for hvert element være det samme på reaktantsiden (før pilen) og på reaktionsproduktets side (efter pilen).
Det siges, at når en reaktion er afbalanceret, overholdes loven om masseaktion.
Derfor er det vigtigt at afbalancere antallet af atomer og de elektriske ladninger på begge sider af pilen i en kemisk ligning. Ligeledes skal summen af masserne af reaktanterne være lig med summen af masserne af produkterne.
For tilfældet med den repræsenterede ligning er den allerede afbalanceret (lige antal A og B på begge sider af pilen).
Eksperimenter, der beviser loven
Metalforbrænding
Lavoiser, der observerede forbrænding af metaller som bly og tin i lukkede beholdere med et begrænset luftindtag, bemærkede, at metallerne var dækket af en forkalkning; og endvidere, at vægten af metallet på et givet opvarmningstidspunkt var lig med begyndelsen.
Da der observeres en vægtforøgelse ved forbrænding af et metal, mente Lavoiser, at den observerede overvægt kunne forklares med en bestemt masse af noget, der fjernes fra luften under forbrænding. Af denne grund forblev massen konstant.
Denne konklusion, som kunne betragtes med et sundt videnskabeligt grundlag, er ikke sådan under hensyntagen til den viden, som Lavoiser havde om iltets eksistens på det tidspunkt, hvor han foreskrev sin lov (1785).
Frigivelse af ilt
Ilt blev opdaget af Carl Willhelm Scheele i 1772. Senere opdagede Joseph Priesley det uafhængigt og offentliggjorde resultaterne af sin forskning, tre år før Scheele offentliggjorde sine resultater på den samme gas..
Priesley opvarmede kviksølvmonoxid og opsamlede en gas, der øgede lysets lysstyrke. Når musene blev anbragt i en beholder med gassen, blev de derudover mere aktive. Priesley kaldte denne dephlogisticized gas.
Priesley rapporterede sine observationer til Antoine Lavoiser (1775), der gentog sine eksperimenter, der viste, at der blev fundet gas i luft og i vand. Lavoiser anerkendte gas som et nyt element og navngav det ilt.
Da Lavoisier brugte som et argument for at fastslå sin lov, at den overskydende masse, der blev observeret i forbrændingen af metaller, skyldtes noget, der blev ekstraheret fra luften, tænkte han på ilt, et element der kombineres med metaller under forbrænding.
Eksempler (praktiske øvelser)
Kviksølvmonoxid-nedbrydning
Hvis 232,6 kviksølvmonoxid (HgO) opvarmes, nedbrydes det i kviksølv (Hg) og molekylært ilt (Oto). Baseret på loven om bevarelse af masse og atomvægte: (Hg = 206,6 g / mol) og (O = 16 g / mol), angiv massen af Hg og Oto der dannes.
HgO => Hg + Oto
232,6 g 206,6 g 32 g
Beregningerne er meget ligetil, da nøjagtigt en mol HgO nedbrydes.
Forbrænding af et magnesiumbælte

Et 1,2 g magnesiumbånd blev forbrændt i en lukket beholder indeholdende 4 g oxygen. Efter reaktionen forblev 3,2 g uomsat ilt. Hvor meget magnesiumoxid der blev dannet?
Den første ting at beregne er den iltmasse, der reagerede. Dette kan let beregnes ved hjælp af en subtraktion:
Masse af Oto der reagerede = startmasse af Oto - slutmasse af Oto
(4 - 3,2) g Oto
0,8 g Oto
Baseret på loven om bevarelse af masse kan massen af dannet MgO beregnes.
Masse af MgO = masse af Mg + masse af O
1,2 g + 0,8 g
2,0 g MgO
Calciumhydroxid
En masse på 14 g calciumoxid (CaO) reagerede med 3,6 g vand (HtoO), som fuldstændigt blev forbrugt i reaktionen til dannelse af 14,8 g calciumhydroxid, Ca (OH)to:
Hvor meget calciumoxid reagerede for at danne calciumhydroxid?
Hvor meget calciumoxid der var tilbage?
Reaktionen kan skitseres ved hjælp af følgende ligning:
CaO + HtoO => Ca (OH)to
Ligningen er afbalanceret. Derfor overholder den loven om bevarelse af masse.
Masse af CaO involveret i reaktionen = masse af Ca (OH)to - masse af HtoELLER
14,8 g - 3,6 g
11,2 g CaO
Derfor beregnes den CaO, der ikke reagerede (den der er tilbage) ved at foretage en subtraktion:
Masse af overskydende CaO = masse til stede i reaktionen - masse, der deltog i reaktionen.
14 g CaO - 11,2 g CaO
2,8 g CaO
Kobberoxid
Hvor meget kobberoxid (CuO) der dannes, når 11 g kobber (Cu) reagerer fuldstændigt med ilt (Oto)? Hvor meget ilt der er brug for i reaktionen?
Det første trin er at afbalancere ligningen. Den afbalancerede ligning er som følger:
2Cu + Oto => 2CuO
Ligningen er afbalanceret, så den overholder loven om bevarelse af masse.
Atomvægten af Cu er 63,5 g / mol, og molekylvægten af CuO er 79,5 g / mol..
Det er nødvendigt at bestemme, hvor meget CuO der dannes ved fuldstændig oxidation af 11 g Cu:
CuO-masse = (11 g Cu) ∙ (1 mol Cu / 63,5 g Cu) ∙ (2 mol CuO / 2 mol Cu) ∙ (79,5 g CuO / mol CuO)
Masse dannet CuO = 13,77 g
Derfor giver forskellen i masserne mellem CuO og Cu den mængde ilt, der er involveret i reaktionen:
Masse af ilt = 13,77 g - 11 g
1,77 g Oto
Natriumchloriddannelse
En masse klor (Clto2,47 g blev omsat med tilstrækkelig natrium (Na), og der blev dannet 3,82 g natriumchlorid (NaCl). Hvor meget Na reagerede?
Balanceret ligning:
2Na + Clto => 2NaCl
I henhold til loven om bevarelse af masse:
Masse af Na = masse af NaCl - masse Clto
3,82 g - 2,47 g
1,35 g Na
Referencer
- Flores, J. Química (2002). Redaktionel Santillana.
- Wikipedia. (2018). Lov om bevarelse af stof. Gendannet fra: es.wikipedia.org
- National Polytechnic Institute. (s.f.). Lov om bevarelse af masse. CGFIE. Gendannet fra: aev.cgfie.ipn.mx
- Helmenstine, Anne Marie, Ph.D. (18. januar 2019). Lov om bevarelse af masse. Gendannet fra: thoughtco.com
- Shrestha B. (18. november 2018). Loven om bevarelse af stof. Kemi LibreTexts. Gendannet fra: chem.libretexts.org



Endnu ingen kommentarer